
(14��)��1����1 L AlCl3��FeCl3�����Һ�м��뺬a mol NaOH����Һʱ�������ij������ɴ����ֵ����������NaOH��Һ��������ʼ�ܽ⣬��ǰ������NaOH�����ﵽb molʱ���������ټ��٣���ԭ��Һ��Fe3+�����ʵ���Ũ��Ϊ ��AlCl3�����ʵ��� ��
��2����֪��2Fe3++2I����=��2Fe2++ I2������2Fe2++Br2 =��2Fe3++2Br��
������1mol FeI2��1.5mol FeBr2����Һ��ͨ��2mol Cl2����ʱ��������������������
�������ٵ���Һ��ͨ��3mol Cl2�������������Ӷ�Ӧ����������ֱ����������� ��
(3������m g��м�뺬�� n gHNO3��������Һǡ����ȫ��Ӧ���� m : n =" 1" : 2.7�� �÷�Ӧ�Ļ�ѧ����ʽΪ __________________________________________________�����軹ԭ����ֻ��һ�֣���ֻ����һ���Σ�
������ n g HNO3��ϡ������Һǡ��ʹ5.6g������ȫ�ܽ⣬���� n/4 gHNO3����ԭ��NO����������ԭ����� n �ķ�ΧΪ_________________________
��ij������п�����ᷴӦʱ�����ʵ���֮��Ϊ2:5����ʱ����Ļ�ԭ������____________
(14��)(1)��4a-3b ��/3��b-a (2) ��I- Fe2+ �� Fe3+ I2 Br2
��3���� 5Fe +12HNO3��5Fe(NO3)2 + N2�� + 6H2O ��16.8 �� n �� 25.2 ��N2O��NH4NO3
���������������1����AlCl3��FeCl3�����ʵ����ֱ���x��y��������йط�Ӧ�Ļ�ѧ����ʽ��AlCl3��3NaOH=Al(OH)3����3NaCl��FeCl3��3NaOH=Fe(OH)3����3NaCl��Al(OH)3��NaOH=NaAlO2��2H2O��֪��3x��3y��amol��x��bmol��amol�����y��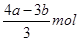 �����������ӵ�Ũ����
�����������ӵ�Ũ����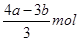 /L��
/L��
��2���ٸ���������ԭ��Ӧ�л�ԭ���Ļ�ԭ��ǿ�ڻ�ԭ����Ŀ�֪����ԭ��ǿ��˳����I����Fe2����Br����2mol�����õ�4mol���ӣ�1mol FeI2ʧȥ3mol������������������1mol�������ӡ�
��3mol�����õ�6mol���ӣ���Һ�е���������2mol���ӣ���������ʧȥ2.5mol�����Ի�������1.5mol�����ӣ�������������Fe3+��I2��Br2��
��3����������������ʵ���֮����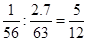 ��������������Ӧ����������������Ӧ�Ļ�ѧ����ʽ��5Fe +12HNO3��5Fe(NO3)2 + N2�� + 6H2O��
��������������Ӧ����������������Ӧ�Ļ�ѧ����ʽ��5Fe +12HNO3��5Fe(NO3)2 + N2�� + 6H2O��
�����������Ӧ�Ļ�ѧ����ʽ������Fe��4HNO3��Fe(NO3)3��NO����2H2O��3Fe��8HNO3��3Fe(NO3)2��2NO����4H2O�����ڷ�Ӧ����1/4�����ᱻ��ԭ�����Ը�������0.1mol��֪���������Сֵ�����ֵ�ֱ���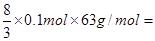 16.8g��
16.8g�� ����n��ȡֵ��Χ��16.8 �� n �� 25.2��
����n��ȡֵ��Χ��16.8 �� n �� 25.2��
����п�����ʵ�����2xmol����������4xmol����������п��2xmol������û�б���ԭ��������4xmol����ԭ��������5xmol��4xmol��xmol�����ݵ��ӵĵ�ʧ�غ��֪�������ڷ�Ӧ�еõ�4�����ӣ�����ԭ������N2O���������û�б���ԭ�����Ტû��ȫ����п���ӽ����������п����Ҳ������������泥���ʱ��Ӧ�Ļ�ѧ����ʽ����4Zn��10HNO3=4Zn(NO3)2��NH4NO3��3H2O�������ȷ�Ĵ���N2O��NH4NO3��
���㣺���������ӡ������Ӻ��������Ʒ�Ӧ���йؼ��㡢������ԭ��Ӧ���й��жϺͼ����Լ����������ᷴӦ���й��жϺͽ���
�����������ѶȽϴ��ؿ���ѧ�����������ۺ����ʣ���ѧ���ļ�����������˸��ߵ�Ҫ��������������ѧ���Ͻ�����˼ά��������ɢ˼ά�����Լ����Ӧ�����������������ѧ����ѧϰЧ�ʺ�Ӧ�������Լ��������⡢����������������ǿѧ����ѧϰ�����ġ�


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
(14��)��������(ClO2)��Ϊһ�ָ�Чǿ�������ѱ����Ϲ�����������֯(WHO)��ΪAI����ȫ�������������¶�������Ϊ����ɫ���ٻ�ɫ���壬���ʷdz����ȶ����¶ȹ���ˮ��Һ��ClO2��������������30���Ⱦ��п�������ը�������Һ��Ӧ�����κ�ˮ��
��1��ij�о�С�������ͼ��ʾʵ���Ʊ�ClO2��Һ���䷴Ӧ�Ļ�ѧ����ʽΪ
���ڷ�Ӧ��ʼ֮ǰ���ձ��е�ˮ���ȵ�80�棬Ȼ��ֹͣ���ȣ���ʹ���¶ȱ�����60��80��֮�䡣�����¶ȵ�Ŀ���� ��ͼʾװ����ȱ�ٵ�һ�ֱ���IJ���������
��װ��A�����ܽ�����Ķ����������壬�������ʢ�� (����ĸ)��
A��20mL 60�����ˮ B��100mL��ˮ
C��100mL����ʳ��ˮ D��100mL��ˮ
������ƿ�м���12.25g KClO3��9g����(H2C2O4)��Ȼ���ټ���������ϡ���ᣬˮԡ���ȣ���Ӧ������ClO2������Ϊ
��2����ClO2������������ˮ(pHΪ5.5��6.5)������һ���������岻���������������()������ˮ��ClO2��
�ĺ��������������������вⶨ��ʵ�鲽�����£�
����1��ȷ��ȡһ�������ˮ��������ƿ�У�
����2������ˮ����pH��7.0��8.0��
����3������������KI���壻
����4����������ָʾ������һ��Ũ�ȵ�Na2S2O3��Һ�ζ����յ㣻
����5���ٵ�����Һ��pH��2.0��
����6����������ͬŨ�ȵ�Na2S2O3��Һ�ζ����յ㡣
�ٲ���1����Ҫ��ȡ20.00mLˮ������Ӧѡ�õ�������
�ڲ���1��4��Ŀ���Dzⶨˮ����ClO2�ĺ������䷴Ӧ�Ļ�ѧ����ʽΪ:
������4�м����ָʾ��Ϊ ���ζ��ﵽ�յ�ʱ��Һ����ɫ�仯Ϊ
�۲���5��Ŀ����ʹ����Һ�е�
��ԭΪ
�Բⶨ�京�����÷�Ӧ�����ӷ���ʽΪ��
��������ˮ���ĺ������꣬�������м���������
��
��ԭΪ
����÷�Ӧ����������Ϊ (�ѧʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭��̩�ݶ��и߶���ѧ�����п��Ի�ѧ��ѡ�ޣ��Ծ��������棩 ���ͣ������
(14��)����ֻ�ܱ�����A��B��A�ܱ��ֺ��ݣ�B�ܱ��ֺ�ѹ����ʼʱ���ݻ���ȵ�A��B�зֱ�ͨ�������NH3���壬ʹ֮������Ӧ��2NH3(g)  3H2(g)��N2(g)�����ﵽƽ�⡣��
3H2(g)��N2(g)�����ﵽƽ�⡣��
��1���ﵽƽ������Ҫ��ʱ�䣺t(A) t(B)��NH3��ת���ʣ�a(A) a(B) (�>������=����<��)��
��2����Ӧ�����еķ�Ӧ���ʣ�v(A) v(B) (�>������=����<��)��
��3���ﵽƽ������������зֱ�ͨ������ĺ�������B�еĻ�ѧƽ���� ��Ӧ�����ƶ���A�еĻ�ѧ��Ӧ���� (���������С�����䡱)��
��4���ﵽƽ������������зֱ�ͨ�������ԭ��Ӧ���壬�ٴδﵽƽ��ʱ��A������H2�İٷֺ��� ��B������NH3�İٷֺ��� (���������С�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012�꽭��ʡ�߶���ѧ�����п��Ի�ѧ���������� ���ͣ������
(14��)��֪CO2(g)��H2(g) CO(g)��H2O(g)��ƽ�ⳣ�����¶ȱ仯���±���
CO(g)��H2O(g)��ƽ�ⳣ�����¶ȱ仯���±���
|
t/�� |
700 |
800 |
850 |
1 000 |
1 200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
��ش��������⣺
(1)��������Ӧ��________��Ӧ(ѡ����ȡ������ȡ�)��
(2)����ƽ����£���ƽ����________�ƶ���CO2ת����________������Ӧ����________(ѡ���������С�����䡱)��
(3)��850�淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ���У�����������Ӧ�����ƶ�����________(ѡ��A��B��C��D��E)
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(4)��850��ʱ�����淴Ӧ��CO2(g)��H2(g) CO(g)��H2O(g)���ڸ������ڸ����ʵ�Ũ�ȱ仯���£�
CO(g)��H2O(g)���ڸ������ڸ����ʵ�Ũ�ȱ仯���£�
|
ʱ��/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O (mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
��3 min��4 minƽ���c3��______________��CO2��ת����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��������е���У�߶���ѧ����ĩ������ѧ�Ծ� ���ͣ������
����14�֣�ʵ�� �����ܼ��š� �͡���̼���á���һ����Ҫ���������ν�CO2ת��Ϊ�����õ���Դ��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������·�����Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��
CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��
��1�����ڸ÷�Ӧ������˵���У���ȷ����____________(����ĸ)��
A��DH��0��DS��0 B��DH��0��DS��0 C��DH��0��DS��0 D��DH��0��DS��0
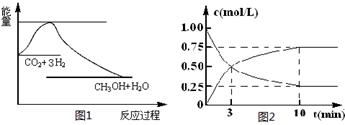
��2��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊl L���ܱ������У�����l mol CO2��3mol H2��һ�������·�����Ӧ��CO2(g)+3H2(g) CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
�ٴӷ�Ӧ��ʼ��ƽ�⣬CH3OH��ƽ����Ӧ����v(CH3OH) �� mol��(L��min)-1��
H2��ת����w(H2) =
�ڸ÷�Ӧ��ƽ�ⳣ������ʽK��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� (����ĸ)��
A�������¶� B����CH3OH(g)��ʱҺ�����
C��ѡ���Ч���� D���ٳ���l molCO2��3 molH2
��3��25�棬1.01��105Paʱ��16g Һ̬�״���ȫȼ�գ����ָ���ԭ״̬ʱ���ų�363.3kJ��������д����ʾCH3OHȼ���ȵ��Ȼ�ѧ����ʽ��
��4��ѡ�ú��ʵĺϽ�Ϊ�缫�����������ơ��״���ˮ������Ϊԭ�ϣ������Ƴ�һ���Լ״�Ϊԭ�ϵ�ȼ�ϵ�أ��˵�صĸ����缫��Ӧʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(14��)��֪CO2(g)��H2(g)CO(g)��H2O(g)��ƽ�ⳣ�����¶ȱ仯���±���
| t/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
��ش��������⣺
(1)��������Ӧ��________��Ӧ(ѡ����ȡ������ȡ�)��
(2)����ƽ����£���ƽ����________�ƶ���CO2ת����________������Ӧ����________(ѡ���������С�����䡱)��
(3)��850�淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ���У�����������Ӧ�����ƶ�����________(ѡ��A��B��C��D��E)
|
| A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(4)��850��ʱ�����淴Ӧ��CO2(g)��H2(g)CO(g)��H2O(g)���ڸ������ڸ����ʵ�Ũ�ȱ仯���£�
| ʱ��/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O (mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
��3 min��4 minƽ���c3��______________��CO2��ת����Ϊ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com