
3.1克H2燃烧时放出热量约为134 kJ,而每千克汽油燃烧时约放热4600 kJ,H2被公认是21世纪替代矿物燃料的理想能源。试述H2作为能源的三个主要优点:![]()
(1)_______________;(2)_______________;(3)_______________。![]()
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:0119 竞赛题 题型:实验题
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg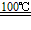 HgBr2+H2
HgBr2+H2  HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑ 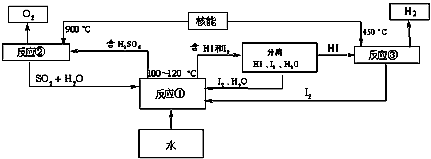

查看答案和解析>>
科目:高中化学 来源: 题型:
“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ?mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ?mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ?mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ?mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg ![]() HgBr2+H2
HgBr2+H2
③HgBr2+CaO ![]() HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO ![]() 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
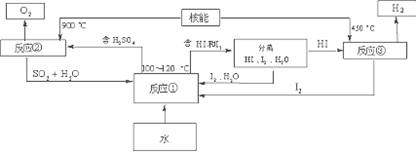
请写出反应①的化学方程式: ;
该法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
查看答案和解析>>
科目:高中化学 来源:0114 期中题 题型:单选题
 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1 查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式,正确的是( )
A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3kJ·mol-1
B.稀的强酸和稀的强碱溶液反应的热化学方程式均为:
![]() +OH-
+OH- H2O(1);![]() ·mol-1
·mol-1
C.在25℃、101 kPa时,1克H2完全燃烧生成H2O放出热量142.9kJ。则:
2H2O(1) 2H2(g)+O2(g);△H= +571.6kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3 H2(g)![]() 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com