
用15.8g高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的盐酸以制取氯气。反应如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积;
(2)被KMnO4氧化的盐酸的体积;
(3)反应中转移的电子总数。
(1)5.6L(2) 42ml (3)3.01×1023(或0.5NA)
解析(1)首先计算15.8g高锰酸钾的物质的量为
设反应生成的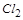 的物质的量为
的物质的量为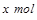 ,则由反应的化学方程式
,则由反应的化学方程式
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
知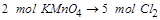
则有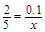 ,解得
,解得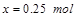
标准状况下产生的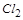 的体积为
的体积为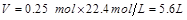
(2)在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,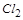 是氧化产物,且
是氧化产物,且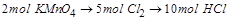
即 能将
能将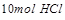 氧化成
氧化成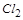
设被氧化的 的物质的量为
的物质的量为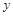 ,则有
,则有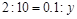 ,解得
,解得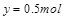
设反应中被氧化的 的体积为
的体积为 ,则有
,则有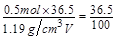
解得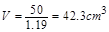 即被氧化的盐酸的体积大约为
即被氧化的盐酸的体积大约为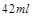
(3)在这个反应中,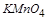 中的
中的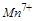 变成了
变成了 中的
中的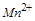 ,反应中每个
,反应中每个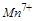 得到了
得到了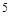 个电子,面参加反应的
个电子,面参加反应的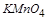 共有
共有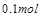 ,所电子转移的总数为
,所电子转移的总数为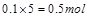 ,即
,即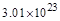 个(或0.5NA)
个(或0.5NA)


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
用15.8g高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的盐酸以制取氯气。反应如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积;
(2)被KMnO4氧化的盐酸的体积;
(3)反应中转移的电子总数。
查看答案和解析>>
科目:高中化学 来源:2014届山东省高一上学期期末考前考试化学试卷 题型:计算题
用15.8g高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的盐酸以制取氯气。反应如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积;
(2)被KMnO4氧化的盐酸的体积;
(3)反应中转移的电子总数。
查看答案和解析>>
科目:高中化学 来源: 题型:
用15.8g高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的盐酸以制取氯气。反应如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积;
(2)被KMnO4氧化的盐酸的体积;
(3)反应中转移的电子总数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com