
������������Դ���������������Ź㷺����;�������õ�ⷨ�Ƹ�������(��֪�������������������²��ȶ�)���ܷ�ӦʽΪFe��2H2O��2OH��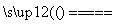 3H2����FeO
3H2����FeO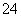 ������˵����ȷ����
������˵����ȷ����
A����Ϊ������H2SO4Ϊ���Һ B����Ϊ������ŨNaOHΪ���Һ
C�����������ĵ缫��ӦΪFe��8OH����6e��===4H2O��FeO
D����ʧȥ3 mol���ӿ����������õ�33.6 L����
 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Na��Cu��Al��Fe���ֽ������ۡ��е����±���ʾ��
| ���� | Na | Cu | Al | Fe |
| �۵㣯�� | 97.5 | 1083 | 660 | 1535 |
| �е㣯�� | 883 | 2595 | 2467 | 2750 |
���в����γɺϽ���ǣ� ����
A��Cu��Na B��Fe��Cu C��Fe��Al D��Al��Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�й����������վ������ʾ��������(PM2.5��)Ϊ������������Ӱ�������������������Ⱦ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
| ���� | K+ | Na+ | NH | SO | NO | Cl�� |
| Ũ��/mol•L��1 | 4��10��6 | 6��10��6 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
���ݱ������ݼ���PM2.5����������pH ����������
��2����������������ʱ������N2��O2��Ӧ���������仯ʾ��ͼ��ͼ3��
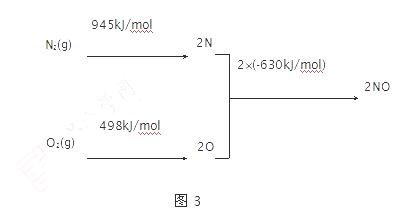
�� N2(g)��O2(g) 2NO(g) ��H��������kJ��mol��1��
2NO(g) ��H��������kJ��mol��1��
�� β���п�������ʱ��NOx�ڴ�ת�����б���ԭ��N2��д��NO��CO��ԭ�Ļ�ѧ����ʽ��������
�� �������Ͳ���ȫȼ��ʱ������CO�������밴���з�Ӧ��ȥCO��
2CO(g)��2C(s)��O2(g),��֪�÷�Ӧ�Ħ�H��0���������ܷ�ʵ�֣� �� ����ܻ��ܡ����������ǡ�������
��ѭ�����ղ���������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ�����������������ͼ4��
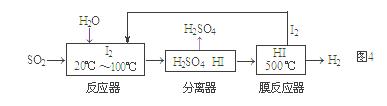
�� �����ӷ���ʽ��ʾ��Ӧ���з����ķ�Ӧ��������
�� �û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������H2��Ŀ���ǡ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��J�ֱ��ʾ��ѧ��ѧ�г��������ʣ�����֮����ת����ϵ��ͼ��ʾ�����ַ�Ӧ�������û���г�������֪��GΪ����Ԫ�صĹ�̬����������£���A��B��C��D��E��F���������о�����ͬһ��Ԫ�ء�����֪FΪ���ɫ������
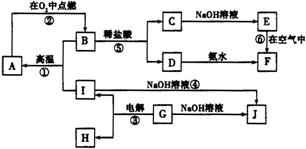
����д���пհף�
��1������G�Ļ�ѧʽ��________��
��2��д����Ӧ�ݵĻ�ѧ����ʽ________��д����Ӧ�ܵ����ӷ���ʽ________��
��3����Ӧ�١����У�������������ԭ��Ӧ����________��������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ò��缫���ij��Һһ��ʱ�䣬����ҺŨ�������pH��С������Һ��
�� A NaOH���� B CuCl2������ C CuSO4������ D H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ݵ���������Ӧ���Ȼ�ѧ����ʽ (i) I2 (g)+ H2(g)  2HI(g) ��H=-9.48 kJ/mol
2HI(g) ��H=-9.48 kJ/mol
(ii) I2(S)+ H2(g) 2HI(g) ��H=+26.48 kJ/mol. �����ж���ȷ����
2HI(g) ��H=+26.48 kJ/mol. �����ж���ȷ����
A��254g I2(g)��ͨ��2gH2(g)����Ӧ����9.48 kJ
B��1 mol��̬����1 mol��̬���������������17.00 kJ
C����Ӧ(i)�IJ���ȷ�Ӧ(ii)�IJ����ȶ�
D����Ӧ(ii)�ķ�Ӧ���������ȷ�Ӧ(i)�ķ�Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ�ص��⻯����������ڹ�ҵ�������������ж��й㷺Ӧ�ã��ش��������⣺
(1)��Ԫ����Ԫ�����ڱ��е�λ��Ϊ ��
(2)NH3��NaClO��Ӧ�ɵõ���(N2H4)���÷�Ӧ�Ļ�ѧ����ʽΪ ��
(3)�¿���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g)= N2O4 (1) ��H1= -19.5kJ��mol-1
��N2H4 (1) + O2(g)= N2(g) + 2 H2O��g�� ��H2= -534.2kJ��mol-1
д���º�N2O4 ��Ӧ���Ȼ�ѧ����ʽ ��
(4)��һ����ȼ�ϵ����һ�ּ��Ե�أ��õ�طŵ�ʱ�������ķ�ӦʽΪ
(5)��ͼ��һ���绯ѧ����ʾ��ͼ��
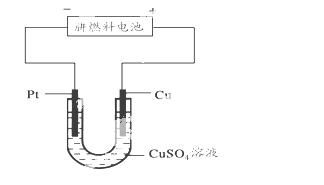
��д����Ƭ�Ϸ����ĵ缫��Ӧʽ____ ____��
�ڼ���ʹ���£�����ȼ�ϵ����Ϊ�������еĵ�Դ��ͭƬ�������仯128 g�����£�����ȼ�ϵ�����������ı�״���µĿ���_____ ___L(��������������������Ϊ20%)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪1.505��1023��X������ӵ�����Ϊ8g����X�����Ħ�������ǣ� ��
A��32g /mol B��16g C��32g D��64g /mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ӡˢ��·ʱ�����Ȼ�����Һ��Ϊ����ʴҺ���������ķ�ӦΪ2FeCl3+Cu==2FeCl2+CuCl2����ʢ���Ȼ�����Һ���ձ���ͬʱ�������ۺ�ͭ�ۣ���Ӧ���������н�������ܳ��ֵ��ǣ� ����
A���ձ�����ͭ���� B���ձ���������ͭ
C���ձ�������ͭ���� D���ձ�������ͭ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com