
【题目】已知一个碳原子上连有两个羟基时,易发生下列转化:![]() 。请根据下图回答:
。请根据下图回答:
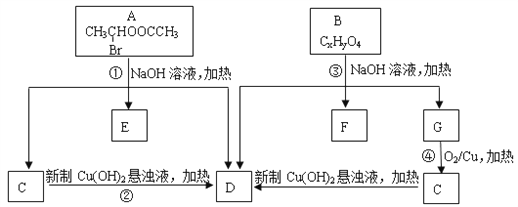
(1)A中所含官能团的名称为________________。
(2)质谱分析发现B的相对分子质量为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,其峰值比为2︰2︰2︰3︰3,其中苯环上的一氯代物只有两种。则B的结构简式为___________________。
(3)写出下列反应方程式:
①____________________________;
④_____________________________。
(4)符合下列条件的B的同分异构体共有________________种。
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相间的位置;③能发生水解反应和银镜反应。
【答案】 酯基、溴原子 ![]()
![]()
![]() 9
9
【解析】(1)根据A的结构简式可知,A中所含官能团的名称为酯基、溴原子;
(2)根据上面的分析可知,B的结构简式为![]() ;
;
(3)反应①的方程式为![]() ,
,
反应 ④的方程式为![]() ;
;
(4)B为![]() ,其同分异构体符合:①属于芳香族化合物,说明有苯环;②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相间的位置;③能发生水解反应和银镜反应,说明有酯基和醛基,则符合条件的B的同分异构体为在苯环的间位连有两个-OOCH和一个-C3H7,有三种排列方法,且-C3H7有2种结构,所以共有6种结构,也可以是在苯环的间位连有两个HCOOCH2-和一个-CH3,有三种排列方法,所以共有9种。
,其同分异构体符合:①属于芳香族化合物,说明有苯环;②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相间的位置;③能发生水解反应和银镜反应,说明有酯基和醛基,则符合条件的B的同分异构体为在苯环的间位连有两个-OOCH和一个-C3H7,有三种排列方法,且-C3H7有2种结构,所以共有6种结构,也可以是在苯环的间位连有两个HCOOCH2-和一个-CH3,有三种排列方法,所以共有9种。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在标准状况下,22.4L水所含分子数目为NA
B. 11.2L HCl气体其物质的量为0.5mol
C. 9克Al转变成Al3+时,得到电子数目为NA
D. 常温时时28g氮气所含氮原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制和治理SO2、NOx是减少酸雨和光化学烟雾的有效途径。
(1)烟气脱琉是大气污染防治研究的热点。脱硫过程涉及的反应如下:
SO2(g)+H2O(l)+HC1O(aq)![]() H2SO4(aq)+HCl(aq) △H=a kJmol-1;
H2SO4(aq)+HCl(aq) △H=a kJmol-1;
Ca(ClO)2(aq)+H2SO4(aq) ![]() CaSO4(s)+2HClO(aq) △H=b kJmol-1。
CaSO4(s)+2HClO(aq) △H=b kJmol-1。
则脱疏反应:Ca(ClO)2(aq)+ 2SO2(g) + 2H2O(l)![]() CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=______(用含a、b的代数式表示) kJmol-1。
CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=______(用含a、b的代数式表示) kJmol-1。
(2)100℃时,向一个1 L的恒容密闭容器中充入0.2 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
时间/min | 0 | t1 | t2 | t3 | t4 |
c(NO2)/mol·L-1 | 0.2 | 0.16 | 0.13 | 0.12 | 0.12 |
①在0~t3时间段内,N2O4的平均反应速率为______molL-1min-1,NO2的平衡转化率为________。
②100℃时,该反应的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.明矾溶于水产生的硫酸根离子有氧化性,可用于净水
D.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如右图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是

A. 根据图示可计算出Ksp(Ag2CO3)=9×10-9
B. 向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C. 反应Ag2CO3(s)+2Cl-(aq)![]() 2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108
2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108
D. 在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AIN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2与NH4Cl溶液共热制N2: NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:A12O3+3C+N2![]() 2AlN+3CO氮化铝在高温下能水解。
2AlN+3CO氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+Na0H+H2O=NaAlO2+NH3↑。
一、氮化铝的制备

(1)实验室中使用的装置如上图所示,请按照氮气气流方向将各个衣器接口连接完整:
e→c→d→___________。(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是_______;E装置内氯化钯溶液的作用可能是________。
二、氮化铝纯度的测定
【方案ⅰ】甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。

(3)为准确测定生成气体的体积,量气装置(虚线框内)中的X液体可以是____。
a.CC14 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AIN纯度的影响是______(填“偏大”、“偏小”或“不变”)。
(5)用下列仪器也能组装一套量气装置,其中必选的仪器有_____(选下列仪器的编号)。
a.单孔塞 b.双孔塞 c.广口瓶 d.容量瓶 e.量筒 f.烧杯
【方案ⅱ】 乙同学按以下步骤测定样品中AIN的纯度。

(6)步骤②的操作是__________。
(7)实验室里煅烧滤渣使其分解,除了必要的热源和三脚架以外,还需要的仪器有_____等。
(8)样品中AIN的纯度是_______(用m1、m2、m3 表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石油、天然气等资源的说法正确的是
A.石油、天然气均为可再生能源B.石油分馏获得的产品为纯净物
C.石油裂化的产物是乙烯D.天然气、沼气的主要成分都是甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com