
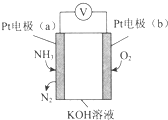
| A. | 溶液中OH-向电极a移动 | |
| B. | O2在电极b上发生还原反应 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 电极a的反应式为2NH3-6e-+6OH-═N2+6H2O |
分析 Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:A.因为a极为负极,则溶液中的阴离子向负极移动,故A正确;
B.氧气在b极发生还原反应,则b极为正极,a极为负极,故B正确;
C.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故C错误;
D.负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故D正确.
故选C.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | (1)(3) | B. | (2)(4) | C. | (1)(2)(4)(6) | D. | (2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
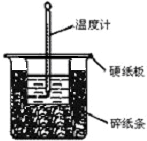 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SiF4)消耗=4v(HF)生成 | B. | HF的体积分数不再变化 | ||
| C. | 容器内气体压强不再变化 | D. | 容器内气体的总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.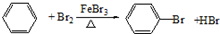 ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③④ | C. | ③④⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠着火可用水扑灭 | |
| B. | 将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体 | |
| C. | 向含有等量NaI、NaCl的溶液中逐滴加入AgNO3溶液,先产生浅黄色沉淀 | |
| D. | 用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com