
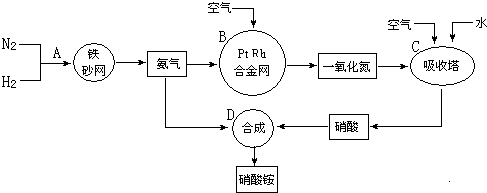

分析 (1)压强过大,可以压碎催化剂,据此答题;
(2)合成硝酸的吸收塔内填充瓷环,可以增大气液接触面积,使二氧化氮被水充分吸收,由于二氧化氮与水反应生成硝酸外还生成一氧化氮,所以吸收塔中补充空气可使NO全部转化成HNO3;
(3)根据NH3的水溶液呈碱性,能使湿润的红色石蕊试纸变蓝,据此检验NH3;
(4)设H2起始物质的量为3amol,则N2起始物质的量为2amol,达到平衡时转化的H2的物质的量为bmol,利用三段式,
N2(g)+3H2(g)?2NH3(g)
开始(mol):2a 3a 0
变化(mol):$\frac{1}{3}$b b $\frac{2}{3}$b
平衡(mol):2a-$\frac{1}{3}$b 3a-b $\frac{2}{3}$b
根据平衡混合气中氨的体积分数为25%,可计算出a、b的关系,进而确定转化率;
(5)由图可知低温主要产物为氮气;900℃时氨气和氧气反应生成一氧化氮和水,根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降;
(6)根据反应N2(g)+3H2(g)?2NH3(g),H2的转化率为60%,10tH2最多可以制取氨气的质量为10t×60%×$\frac{17}{3}$=34t,NH3催化氧化制HNO3时的损失20%的氨,再根据氨与硝酸按1:1生成硝酸铵,可计算出硝酸铵的质量.
解答 解:(1)压强过大,可以压碎催化剂,缩短催化剂寿命,所以压强不能过大,
故答案为:压碎催化剂,缩短催化剂寿命;
(2)合成硝酸的吸收塔内填充瓷环,可以增大气液接触面积,使二氧化氮被水充分吸收,由于二氧化氮与水反应生成硝酸外还生成一氧化氮,所以吸收塔中补充空气可使NO全部转化成HNO3,
故答案为:增大气液接触面积;可使NO全部转化成HNO3;
(3)根据NH3的水溶液呈碱性,能使湿润的红色石蕊试纸变蓝,据此检验NH3,检测的简单方法为用湿润的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处,
故答案为:用湿润的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处;
(4)设H2起始物质的量为3amol,则N2起始物质的量为2amol,达到平衡时转化的H2的物质的量为bmol,利用三段式,
N2(g)+3H2(g)?2NH3(g)
开始(mol):2a 3a 0
变化(mol):$\frac{1}{3}$b b $\frac{2}{3}$b
平衡(mol):2a-$\frac{1}{3}$b 3a-b $\frac{2}{3}$b
根据题意可知,$\frac{\frac{2}{3}b}{2a-\frac{1}{3}b+3a-b+\frac{2}{3}b}$=25%,所以3a=2b,此时H2的转化率为$\frac{b}{3a}$×100%=50%,
故答案为:50%;
(5)由图可知低温主要产物为氮气N2,900℃时氨气和氧气反应生成一氧化氮和水,反应方程式为4NH3(g)+5O2(g)$\frac{\underline{\;催化剂\;}}{△}$4NO(g)+6H2O,生成NO的反应为放热反应,升高温度平衡向逆反应方向移动,NO的转化率下降,合成塔反应过程中产生NO,为充分利用,补充空气会进一步与NO反应生成硝酸,
故答案为:N2;4NH3(g)+5O2(g)$\frac{\underline{\;催化剂\;}}{△}$4NO(g)+6H2O;生成NO的反应为放热反应,升高温度,平衡向逆反应方向移动,NO的产率下降;
(6)根据反应N2(g)+3H2(g)?2NH3(g),H2的转化率为60%,10tH2最多可以制取氨气的质量为10t×60%×$\frac{17}{3}$=34t,设被氧化的氨气为xt,NH3催化氧化制HNO3时的损失20%的氨,则生成的硝酸为xt×(1-20%)×$\frac{63}{17}$,氨与硝酸按1:1生成硝酸铵,所以有$\frac{34t-xt}{17}$=$\frac{xt×(1-20%)×\frac{63}{17}}{63}$,则x=18.89,所以硝酸铵的质量为(34t-xt)×$\frac{80}{17}$=71.1t,
故答案为:71.1.
点评 本题主要考查了工业合成氨与制备硝酸,同时考查了化学平衡计算,综合性较强,难度较大,正确理解各物质之间的反应是解题的关键,对学生分析问题和解决问题的能力要求较高.


科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
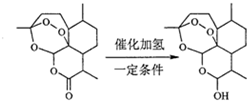
| A. | 青蒿素分子中治疗疟疾的活性基团是过氧基 | |
| B. | 双氢青蒿素分子比青蒿素分子多1个手性碳原子 | |
| C. | 理论上每摩尔青蒿素水解需要消耗1molNaOH | |
| D. | 每摩尔双氢青蒿素可以与1molNaHCO3反应生成1molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4(mol/L) 2 | B. | 16(mol/L) 2 | C. | 20(mol/L) 2 | D. | 25(mol/L) 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥⑦ | B. | ①②⑤⑦⑧ | C. | ②③④⑤⑥ | D. | ①③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向酸性KMnO4溶液中滴加足量H2O2 | 溶液的紫红色消失 | 双氧水有漂白性 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向某无色溶液中滴加足量稀盐酸 | 产生白色沉淀 | 该无色溶液中一定存在Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的盐酸溶液中含有NA个H+ | |
| B. | 标准状况下,11.2LH2O所含的分子数为0.5NA | |
| C. | 7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.1NA | |
| D. | 常温常压下,8g甲烷所含的中子数为5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com