
| A. | 碱性锌锰电池 | B. | 手机用锂电池 | C. | 汽车用铅蓄电池 | D. | 玩具用镍氢电池 |
科目:高中化学 来源: 题型:解答题
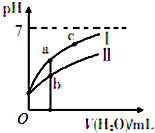 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | K$_{{a}_{1}}$a1=4.4×10-7K$_{{a}_{2}}$a2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LC6H14中含有1.9NA个共用电子对 | |
| B. | 7.8gNa2O2固体中含阴离子数目为0.1NA | |
| C. | 含36.5gHCl的浓盐酸与足量的二氧化锰作用,能产生0.25NA个氯气分子 | |
| D. | 5.6gFe与足量的氯气反应转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
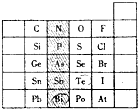 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2 中有4 NA个离子 | |
| B. | 常温常压下,11.2L氧气所含的原子数为NA | |
| C. | 1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子 | |
| D. | 42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-═2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-═2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com