
【题目】下表为元素周期表的局部X、Y、Z、W均为短周期元素,其原子序数之和为47:
X | |||||
Y | Z | W |
(1)X、Y、Z、W的元素符号依次为_______、________、_______、__________(以下所有问题均用元素符号回答);
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为_____;将该化合物的固体溶于足量W的气态氢化物水溶液中,生成两种盐该反应的离子方程式为______________,生成的两种盐的电子式为__________、_____________;
(3)Z的氧化物为_________(填酸性、碱性、两性、不成盐)氧化物,Y、Z、W的最高价氧化物对应的水化物两两之间反应的化学方程式为:![]() __________________________________;
__________________________________;![]() ___________________________;
___________________________;![]() ________________________.
________________________.
【答案】N Na Al S ![]() Na3N + 4H2S = NH4+ + 4HS- + 3Na+
Na3N + 4H2S = NH4+ + 4HS- + 3Na+ ![]()
![]()
![]() 两性 Al(OH)3 + NaOH = NaAlO2 +2H2O 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 3H2O H2SO4 + 2NaOH = Na2SO4 + 2H2O
两性 Al(OH)3 + NaOH = NaAlO2 +2H2O 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 3H2O H2SO4 + 2NaOH = Na2SO4 + 2H2O
【解析】
X、Y、Z、W均为短周期元素,根据表中结构,可知X为第二周期元素,Y、Z、W为第三周期元素,同主族二三周期原子序数相差8,设X的原子序数为x,则Y的原子序数为x+8-4,Z的原子序数为x+8-2,W的原子序数为x+8+1,再根据原子序数之和为47列式:47=x+ x+8-4+ x+8-2+ x+8+1,解得x=7,故X为N,Y为Na,Z为Al,w为S。据此回答。
(1)据分析可知X为N,Y为Na,Z为Al,W为S,故答案为:N、Na、Al、S;
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,所以化学式为Na3N,电子式为![]() ,Na3N固体溶于足量H2S水溶液中,化学反应方程式为:Na3N + 4H2S = NH4HS + 3NaHS,所以离子方程式:Na3N + 4H2S = NH4+ +4HS- + 3Na+,NH4HS的电子式为
,Na3N固体溶于足量H2S水溶液中,化学反应方程式为:Na3N + 4H2S = NH4HS + 3NaHS,所以离子方程式:Na3N + 4H2S = NH4+ +4HS- + 3Na+,NH4HS的电子式为![]()
![]() ,NaHS的电子式为:
,NaHS的电子式为:![]() ;
;
(3)Z的氧化物为Al2O3,Al2O3属于两性氧化物,Y、Z、W的最高价氧化物对应的水化物分别为NaOH、Al(OH)3、H2SO4,两两之间反应的化学方程式为:Al(OH)3 + NaOH = NaAlO2 + 2H2O,2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 3H2O,H2SO4 + 2NaOH = Na2SO4 + 2H2O。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是( )
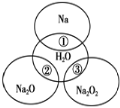
A.反应③最多能产生0.05molO2
B.反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑
C.①、②、③都属于氧化还原反应
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应xH2S(g)![]() xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
A.若恒容充入H2,则新平衡后H2S分解率下降
B.若增大压强,气体颜色变深,则Sx为有色气体
C.若恒容升温后,气体密度不变,说明达到了新平衡
D.若改变某一条件后,压强不能作为判断新平衡的标志,则Sx状态发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在丰富的碳、氮、氧、铝、钾、铁、碘等元素,按要求回答下列问题:
(1)常温,羰基铁[Fe(CO)x)]是红棕色液体,不溶于水,溶于乙醇、乙醚等,据此判断羰基铁晶体属于________________(填晶体类型),羰基铁的配体是________。已知:羰基铁的中心原子价电子数与配体提供电子数之和为18,则x=_________;98g羰基铁中含有的![]() 键数为______________个。
键数为______________个。
(2)亚铁离子具有强还原性,从电子排布的角度解释,其原因是__________
(3)BN晶体、AlN晶体结构相似,如图1,两者熔沸点较高的物质是______,原因是_________

(4)KIO3晶体是一种性能良好的光学材料,其晶胞为立方体,晶胞中K、I、O分别处于顶点、体心、面心位置,如图2所示,如果KIO3密度为a g![]() cm-3,则K与O间的最短距离为___cm。
cm-3,则K与O间的最短距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是 ( )
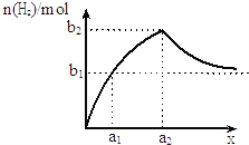
A.a1=![]() B.a2=1C.b1=
B.a2=1C.b1= ![]() D.b2=
D.b2=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是______(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为85
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
Ⅱ.在稀硫酸中,MnO和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(2)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
(3)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是______mol。
Ⅲ.高锰酸钾溶液与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
(4)若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)来制备FeCO3,其流程如图:
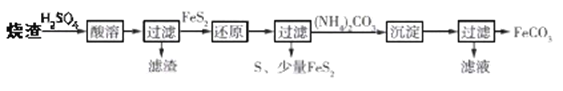
已知:①FeS2不溶于稀硫酸;②“还原”时,Fe3+通过两个反应被还原,其中一个反应为 FeS2+14Fe3++8H2O=15Fe2++2![]() +16H+ 。
+16H+ 。
下列说法不正确的是( )
A.“还原”时另一个反应的离子方程式为2Fe3++FeS2=2S+3Fe2+
B.“还原”后可以用KSCN检验Fe3+是否反应完全
C.流程中多次进行过滤,过滤所用的玻璃仪器为烧杯、漏斗、胶头滴管和玻璃棒
D.所得FeCO3需充分洗涤,可以用稀盐酸和BaCl2溶液检验FeCO3是否已洗涤干净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漆酚![]() 是生漆的主要成分,黄色,能溶于有机溶剂。生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,它不具有的化学性质为( )
是生漆的主要成分,黄色,能溶于有机溶剂。生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,它不具有的化学性质为( )
A.可以燃烧,当氧气充分时,产物为CO2和H2O
B.与FeCl3溶液发生显色反应
C.能发生取代反应和加成反应
D.能与碳酸氢钠溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。不考虑溶液混合引起的体积变化和H2S的挥发,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1mol·L-1NaHS溶液:c(Na+)>c(HS-)>c(H2S)>c(S2-)
B.0.1mol·L-1Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.0.2mol·L-1NaHS溶液和0.1mol·L-1NaOH溶液等体积混合:c(HS-)+3c(H2S)>c(S2-)
D.向0.1mol·L-1NaOH溶液中通入H2S至溶液呈中性:c(Na+)=c(HS-)+c(S2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com