

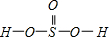 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为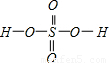 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强; =3,有1对孤对电子对,为V形;SO32-离子中心原子S原子的价层电子对数为
=3,有1对孤对电子对,为V形;SO32-离子中心原子S原子的价层电子对数为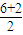 =4,有1对孤对电子对,为三角锥型,
=4,有1对孤对电子对,为三角锥型,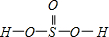 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+,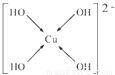 ,故答案为:
,故答案为: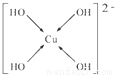 ;
; ×8+
×8+ ×6=4,含Cu:4,所以化学式为CuCl,故答案为:CuCl.
×6=4,含Cu:4,所以化学式为CuCl,故答案为:CuCl.

科目:高中化学 来源: 题型:
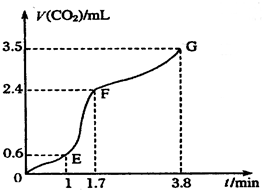 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| m | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
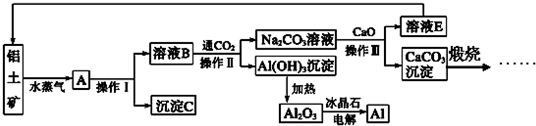
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com