
X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高。N原子外围未成对电子数是同周期中最多的。W元素的电离能数据见下表(kJ·mol-1):
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)W2Y2含有的电子式为 。灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因: 。
(2)N元素基态原子的外围电子排布式是: 。
(3)X3-的空间构型是 ,中心原子的杂化方式是 。
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键 。
(共13分)
(1)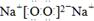 (2分)在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色(2分,提到“电子跃迁”即可得分)
(2分)在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色(2分,提到“电子跃迁”即可得分)
(2)3d54s1 (2分)
(3)直线型 sp(每空2分)
(4)F—H…F F—H…O O—H…F O—H…O(3分,写对1个就得1分)
【解析】
试题分析:根据题中信息得,X、Y、Z的氢化物中都含有氢键,故X为N元素;Y为O元素;Z为F元素。N原子外围未成对电子数是同周期中最多的,N为二十四号元素铬(Cr)。六对,d五对,s一对。根据W元素的电离能数据可以出,第一电离能远大于第二电离能,W原子最外层为1个电子,W为Na元素。
(1)W2Y2是Na2O2,电子式为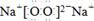 。。灼烧Na2O2时,火焰呈黄色,发生的是焰色反应,原理是在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色。
。。灼烧Na2O2时,火焰呈黄色,发生的是焰色反应,原理是在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色。
(2)N元素是Cr元素,其基态原子的外围电子排布式是d54s1。
(3)X3-为N3-,空间构型是直线型,中心原子的杂化方式是sp。
(4)Z的氢化物为HF,其氢键的表示式是F—H…F F—H…O O—H…F O—H…O。
考点:位置结构性质的相互关系应用 元素电离能、电负性的含义及应用 氢键 原子轨道杂化方式及杂化类型判断 电子式 电子跃迁
点评:题目综合性较大,涉及位置结构性质的相互关系应用、元素电离能和电负性的含义及应用、氢键、原子轨道杂化方式及杂化类型判断、电子式、电子跃迁等,难度中等,是物质结构的综合性题目,是对学生综合能力的考查,氢化物的沸点比它们同族相邻周期元素氢化物的沸点高是推断的突破口。


科目:高中化学 来源: 题型:
(12分)X、Y、Z、W、N五种元素中,X原子核外的M层中只有两个成对电子,Y原子的外围电子排布式为nsnnpn+1,Z是地壳内含量(质量分数)最高的元素,W的核电荷数是X与Z的核电荷数之和,N在元素周期表的各元素中电负性最大。
(1)Z元素基态原子的电子排布图为
(2)W的元素符号是 ,在周期表中的位置是 ,其基态原子的电子排布式为 ,在形成化合物时它的最高化合价为
(3)Y的氢化物的VSEPR模型是 ,属于 分子(填极性或非极性),
(4)X的氢化物的沸点 Z的氢化物的沸点(填大于、小于或等于)
原因是
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁葫芦岛第一高级中学高二下学期期中考试化学试卷(带解析) 题型:单选题
X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高。N原子外围未成对电子数是同周期中最多的。W元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年黑龙江佳一中高二第三学段考试化学试卷(选修3) 题型:填空题
(12分)X、Y、Z、W、N五种元素中,X原子核外的M层中只有两个成对电子,Y原子的外围电子排布式为nsnnpn+1,Z是地壳内含量(质量分数)最高的元素,W的核电荷数是X与Z的核电荷数之和,N在元素周期表的各元素中电负性最大。
(1)Z元素基态原子的电子排布图为
(2)W的元素符号是 ,在周期表中的位置是 ,其基态原子的电子排布式为 ,在形成化合物时它的最高化合价为
(3)Y的氢化物的VSEPR模型是 ,属于 分子(填极性或非极性),
(4)X的氢化物的沸点 Z的氢化物的沸点(填大于、小于或等于)
原因是
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com