
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
分析 (1)根据CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;可得①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8•mol -1,
③H2O(l)═H2O(g)△H=+44kJ•mol-1,
根据盖斯定律①-②-③可得CO(g)+H2O(g)=CO2 (g)+H2 (g),计算可得;
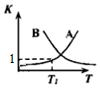
(2)正反应为放热反应,升高温度,平衡向逆向移动,K值减小;
(3)设平衡时水蒸气的转化率为a,列三段式,根据图可知T1℃时,K=1,代入K可得;
(4)根据化学平衡时,正逆反应速率相等,各组分浓度保持不变判断;
(5)①该反应是放热反应,根据温度对化学平衡的影响判断;
②维持温度不变,要使CO的转化率升高,可用加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
③该反应是气体体积不变的反应,设反应前气体总体积为VL,计算出反应前CO、二氧化碳的体积;$\frac{n({H}_{2}O)}{n(CO)}$=1,则加入水蒸气的体积与CO的体积相等,从而得出反应达到平衡时总体积;然后根据反应方程式、达到平衡时CO的体积分数计算出反应生成氢气的体积,再计算出氢气的体积分数.
解答 解:(1)根据CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;可得①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8•mol -1,
③H2O(l)═H2O(g)△H=+44kJ•mol-1,
根据盖斯定律①-②-③可得CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
故答案为:CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
(2)正反应为放热反应,升高温度,平衡向逆向移动,K值减小,曲线为B;
故答案为:B;正反应为放热反应,升高温度,平衡向逆向移动,K值减小;
(3)容积固定为5L的容器,设平衡时水蒸气的转化率为a,列三段式:
CO(g)+H2O(g)=CO2 (g)+H2 (g)
起始(mol/L):0.6 0.4 0 0
转化(mol/L):0.4a 0.4a 0.4a 0.4a
平衡(mol/L):0.6-0.4a 0.4-0.4a 0.4a 0.4a
根据图可知T1℃时,K=$\frac{0.4a×0.4a}{(0.6-0.4a)×(0.4-0.4a)}$=1,解得,a=0.6=60%;
故答案为:60%;
(4)反应 CO(g)+H2O(g)=CO2 (g)+H2 (g):
a.该反应是气体体积不变,任何时刻容器内压强都一样,故a错误;
b.混合气体总质量不变,恒容容器体积不变,根据$ρ=\frac{m}{V}$混合气体的密度不改变,故b错误;
c.单位时间内生成a mol CO2说明生成了a mol的H2,同时消耗a molH2,说明正逆反应速率相等,故c正确;
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6,设容器体积为V,则此时Qc=$\frac{(6÷V)×(6÷V)}{(9÷V)×(4÷V)}$=1=K,反应在平衡状态,故d正确;
故答案为:c d;
(5)①该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
故答案为;T2<T3<T4;该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
②维持温度不变,要使CO的转化率升高,可用加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
故答案为:加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
③反应CO(g)+H2O(g)?CO2(g)+H2(g)中,反应恰好气体的体积不变,则反应过程中气体的总体积不变,设反应前气体总体积为V,则CO的体积为30%VL=0.3VL,二氧化碳的体积为:10V%=0.1V,
由于$\frac{n({H}_{2}O)}{n(CO)}$=1,则加入的水蒸气的体积为30%V,反应达到平衡时气体总体积为:V+0.3V=1.3V,
温度为300℃达到平衡时CO的体积分数为6%,则反应消耗的CO=生成的H2的体积=0.3V-1.3V×6%=0.222V,达到平衡时H2的体积分数为$\frac{0.222V+0.4V}{1.3V}$×100%=47.8%;
故答案为:47.8%.
点评 本题考查了化学平衡、化学平衡常数的计算、影响化学反应速率、化学平衡的因素等知识,题目难度较大,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
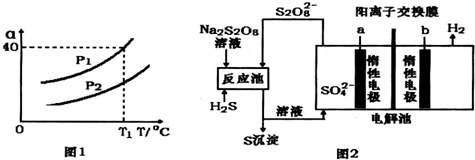
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
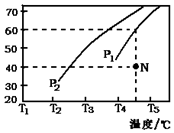
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 |
| 温度 | T1 | T2 | T2 |
| A. | 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1℃时,若起始时间向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<c(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
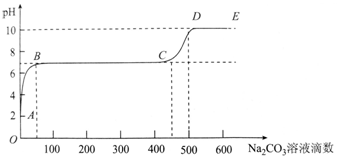
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com