
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
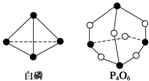 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )| A. | 吸收1 638 kJ能量 | B. | 放出1 638 kJ能量 | ||
| C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铜、碳、氮、硫、氯等是组成物质的重要元素.
铜、碳、氮、硫、氯等是组成物质的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4中溶液,滴加紫色石蕊溶液 | 溶液变红的是① ④溶液 | 略 |
2 | 向含酚酞的NaOH溶液中,各滴加等量②③两 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学的化学方程式: |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的溶液的酸性 | 略 | CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | 反应的化学方程式: | |
| 结论:由强到弱顺序(填序号) | |||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,反应类型是加聚反应.
,反应类型是加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于100/ρmL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com