
| A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体 |
| B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体 |
| C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
| D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源:不详 题型:单选题
| A.①⑤②①④③ | B.①⑤⑥②④③ |
| C.③④②⑥⑤① | D.②⑤①④③⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl、CO2、H2 | B.CO、H2、H2O |
| C.CO、H2、NH3 | D.HCl、CO、H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用Ca(OH) 2溶液鉴别SO2和CO2 |
| B.用氢氧化钠溶液鉴别AlCl3溶液和MgCl2溶液 |
| C.用Na2CO3溶液鉴别HCl溶液和H2SO4溶液 |
| D.用焰色反应鉴别NaCl、KNO3和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:?
从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:?| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
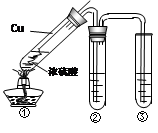
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2 | B.H2SO4 | C.NaOH | D.AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com