
|
如图所示,
| |
A. |
2NH3(g) |
B. |
H2(g)+I2(g) |
C. |
4NH3(g)+5O2(g) |
D. |
C(s)+H2O(g) |
科目:高中化学 来源: 题型:阅读理解

| 滴定 次数 |
量取KMnO4溶液的体积(mL) | 标准草酸溶液的体积 | 平均值 (mL) | ||
| 滴定前刻度 | 滴定后刻度 | 实际体积(mL) | |||
| 第一次 | 5.00 | 0.00 | 19.60 | ||
| 第二次 | 5.00 | 0.20 | 19.60 | ||
| 第三次 | 5.00 | 0.06 | 18.06 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:



 或
或
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:
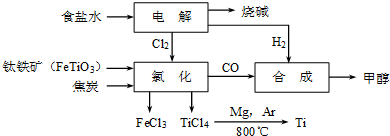
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
①X的化学式为 ;
②上图中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响 B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母代号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
,
②氨水中水电离出的c(OH-) 10-7mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大以小依次为 。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高三2月月考(理综)化学部分 题型:填空题
(18分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。

①X的化学式为 ;
②上图中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响 B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母代号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。

(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
,
②氨水中水电离出的c(OH-) 10-7mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大以小依次为 。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com