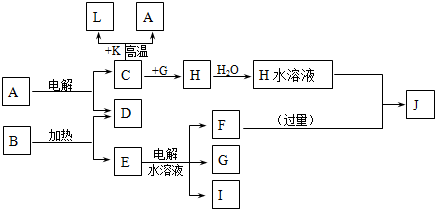
解:C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色判断为Cl
2;形成D的元素的原子最外层电子数是次外层的3倍推断为氧元素;B在焰色反应中呈紫色(透过蓝色钴玻璃)说明含有钾元素;K为红棕色粉末,判断为Fe
2O
3;L是常见金属,结合转化关系:C+K(Fe
2O
3)=L(Fe)+A;说明C为Al,A为Al
2O
3,H为AlCl
3,转化关系E的水溶液电解得到F、G(Cl
2)、I在G中燃烧判断I为H
2,生成的产物为HCl,B加热生成D(O
2)和E,判断E为KClO
3,E为KCl,F为KOH;J为NaAlO
2;
(1)I(H
2)在G(Cl
2)中燃烧时生成氯化氢,在瓶口氯化氢遇到水蒸气形成盐酸小液滴,反应的现象为:火焰呈苍白色,并有白雾出现,故答案为:火焰呈苍白色,并有白雾出现;
(2)依据判断可知,L为Fe,电解E(KCl)水溶液的化学方程式为:2KCl+2H
2O

2KOH+H
2↑+Cl
2↑,故答案为:2KCl+2H
2O

2KOH+H
2↑+Cl
2↑;
(3)C(Al)与K(Fe
2O
3)反应是铝热反应,反应的化学方程式为:2Al+Fe
2O
3 
Al
2O
3+2Fe;引发该铝热反应的操作为:在Al与Fe
2O
3混合物中加KClO
3粉末,插上镁条,点燃镁条,故答案为:2Al+Fe
2O
3
Al
2O
3+2Fe;在Al与Fe
2O
3混合物中加KClO
3粉末,插上镁条,点燃镁条;
(4)J(NaAlO
2 )与H(AlCl
3)反应发生双水解反应,反应的离子方程式为:Al
3++3AlO
2-+6H
2O=4Al(OH)
3↓;若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,发生的反应为:Al
2O
3~2Al~2Al
3+;KClO
3~KCl~KOH,若铝离子和过量氢氧化钾反应生成J为NaAlO
2,则Al
3++4OH
-=AlO
2-;依据反应可知,需要Al
2O
3和KClO
3物质的量为1:8反应生成NaAlO
2,故答案为:1:8.
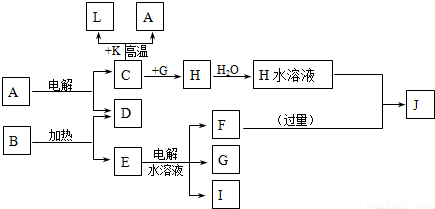
分析:C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色判断为Cl
2;形成D的元素的原子最外层电子数是次外层的3倍推断为氧元素;B在焰色反应中呈紫色(透过蓝色钴玻璃)说明含有钾元素;K为红棕色粉末,判断为Fe
2O
3;L是常见金属,结合转化关系:C+K(Fe
2O
3)=L(Fe)+A;说明C为Al,A为Al
2O
3,H为AlCl
3,转化关系E的水溶液电解得到F、G(Cl
2)、I在G中燃烧判断I为H
2,生成的产物为HCl,B加热生成D(O
2)和E,判断E为KClO
3,E为KCl,F为KOH;J为NaAlO
2,依据推断出的各物质回答问题.
点评:本题考查了原子结构和元素判断,物质转化关系,铝及其化合物性质的应用,主要考查实验室制氧气、电解氯化钾溶液,电解制铝单质,铝热反应,原子守恒的计算应用.


 2KOH+H2↑+Cl2↑,故答案为:2KCl+2H2O
2KOH+H2↑+Cl2↑,故答案为:2KCl+2H2O 2KOH+H2↑+Cl2↑;
2KOH+H2↑+Cl2↑; Al2O3+2Fe;引发该铝热反应的操作为:在Al与Fe2O3混合物中加KClO3粉末,插上镁条,点燃镁条,故答案为:2Al+Fe2O3
Al2O3+2Fe;引发该铝热反应的操作为:在Al与Fe2O3混合物中加KClO3粉末,插上镁条,点燃镁条,故答案为:2Al+Fe2O3 Al2O3+2Fe;在Al与Fe2O3混合物中加KClO3粉末,插上镁条,点燃镁条;
Al2O3+2Fe;在Al与Fe2O3混合物中加KClO3粉末,插上镁条,点燃镁条;