
【题目】实验室以Na2SO3粉末和70%H2SO4为原料制取SO2, 且以SO2为原料制取物质和进行性质探究。回答下列问题:
(1)学生甲欲收集一瓶干燥的SO2,选择图中的装置,其连接顺序为_________ (按气流方向,用小写字母表示); SO2有毒,为防止中毒实验应在_________中进行。

(2)学生乙欲通过量气法测定在空气中久置的亚硫酸钠粉末的纯度,最好选择下列装置 中 的_________(填字母) 。

(3)学生丙欲以CuSO4·5H2O 和SO2 等为原料制备谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)实验装置如右图所示。已知谢弗勒尔盐是一种深红色固体,不溶于水和乙醇,100℃时发生分解。

回答下列问题:
装置A中SO2的作用是___________________; 体 系 温度 控 制 在 60~80℃ 的目的是___________。装置B的作用是_________。
(4)学生丁欲利用右图装置探究SO2使品红溶液褪色的实质。实验中观察到Ⅰ中红色褪去;Ⅱ中无现象。据此推断能使品红水溶液褪色的粒子可能是_________。如果要比较这些粒子使品红溶液褪色的快慢,请设计实验方案,简述操作和需要观察的现象________________。

【答案】 abcedbcf 通风橱 C 作还原剂和酸性氧化物,生成+1价的铜和SO32- 加快反应速率,防止产品分解 安全瓶,防倒吸 H2SO3分子、HSO32-、SO32-离子等 取三个小烧杯,分别加入等体积的品红溶液,然后加入等体积、等物质的量浓度的Na2SO3溶液、NaHSO3溶液、NaHSO3和硫酸溶液,观察品红溶液褪色的快慢,记录品红溶液褪色需要的时间(其他合理答案也给分)
【解析】本题主要考查制取以Na2SO3粉末和70%H2SO4为原料制取SO2,且以SO2为原料制取物质和进行性质探究的实验。主要涉及SO2的性质等。
(1)学生甲欲收集一瓶干燥的SO2,选择图中的装置,需要在装置B干燥SO2,在装置C用向上排空气法收集SO2,在装置D吸收SO2尾气,为了防止吸收装置D中水蒸气混入SO2,需要在装置C、D之间重复利用装置B,所以装置的连接顺序为abcedbcf,SO2有毒,为防止中毒实验应在通风橱中进行。
(2)学生乙欲通过量气法测定在空气中久置的亚硫酸钠粉末的纯度,最好选择下列装置中的C。因为A.针筒内外筒之间具有摩擦力,影响精确度,B.如果反应温度不是室温会产生误差,C.合适,D.用排水法收集气体时,锥形瓶内气压大于大气压,因此带来误差,故选C。
(3)装置A中SO2的作用是作还原剂和酸性氧化物,生成+1价Cu和SO32-;体系温度控制在60~80℃的目的是加快反应速率,防止产品分解。装置B的作用是安全瓶,防倒吸。
(4)据此推断能使品红溶液褪色的粒子可能是SO2与水反应产生的H2SO3分子、HSO32-、SO32-离子等。如果要比较这些粒子使品红溶液褪色的快慢,设计实验方案,简述操作和需要观察的现象:取三个小烧杯,分别加入等体积的品红溶液,然后加入等体积、等物质的量浓度的Na2SO3溶液、NaHSO3溶液、NaHSO3和硫酸溶液,观察品红溶液褪色的快慢,记录品红溶液褪色需要的时间。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
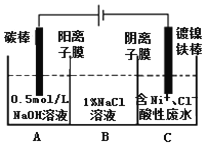
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2经反应①和反应②转化为NO2,其能量变化随反应进程的图示如下。

①2NO(g)![]() N2O2(g)△H1平衡常数K1
N2O2(g)△H1平衡常数K1
②N2O2(g)+O2(g)![]() 2NO2(B)△H2平衡常数K2
2NO2(B)△H2平衡常数K2
下列说法不正确的是( )
A. △H1<0,△H2<0
B. 2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=K1/K2
2NO2(g)的平衡常数K=K1/K2
C. 表示2NO(g)+O2(g)![]() 2NO2(g)的△H=△H1+△H2
2NO2(g)的△H=△H1+△H2
D. 反应②的速率大小决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是一类用途广泛的金属材料,下列关于合金的描述正确的是( )
A.合金的硬度比组成它的成分金属小
B.在我国,使用最早的合金是青铜
C.合金的熔点一般比组成它的成分金属高
D.目前用量最大、用途最广的合金是铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:

已知: R-X![]() R-OH(R-X为卤代烃,R-代表烃基)
R-OH(R-X为卤代烃,R-代表烃基)
(1)B和A为同系物,B的结构简式为_______________。
(2)C2H6O分子中官能团的名称______________;反应③的反应类型为________________。
(3)C的结构简式为_______________________。
(4)反应②的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A.H2SO4=H2++SO42﹣
B.Ba(OH)2=Ba2++OH ﹣
C.NaNO3=Na ++NO3﹣
D.CuSO4=Cu+2+SO4﹣2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1,其结构简式如下图所示,它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性。下列说法正确的是
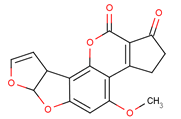
A. 黄曲霉素分子中所有的原子肯定均共面
B. 黄曲霉素分子中含有4个手性碳原子
C. 1mol黄曲霉素最多能与5 mol H2发生加成反应
D. 黄曲霉素可以发生取代、加成、还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,对于等质量的SO2和CO2两种气体,求其下列各项比值。
(1)摩尔质量比___________;
(2)密度比___________;
(3)物质的量比___________;
(4)体积比为___________;
(5)分子数比___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸。请填写以下空白。

(1)A、B、C、D的化学式分别是___________、___________、___________、___________。
(2)A→B的化学方程式是___________。
(3)C→D的离子方程式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com