
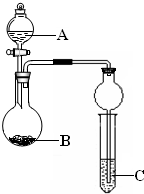
 某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:

科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
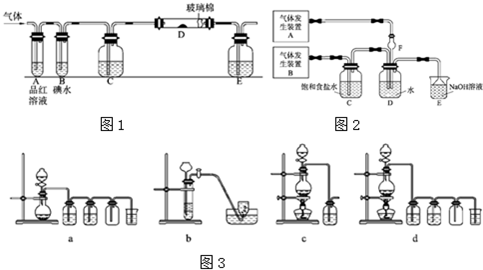
(10分)以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省高三上学期期中考试理科综合试题(化学部分) 题型:实验题
(18分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调
节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
②步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
、 、 NaOH。
③步骤2中,判断加入BaCl2已过量的方法是
________________________。
(2)为检验精盐纯度,需配制100 mL 0.5mol/L(精盐)溶液,右图是该
同学转移溶液的示意图,图中的错误是

________________________________________________。
若在定容时仰视,则所配溶液的浓度_______0.5mol/L(填>或<)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则相同条件下收集的Cl2 (填>、=或<)
2L,原因
(4)某学习小组设计了如下图实验,将氯气依次通过下列装
置以验证氯气的性质:


①通入氯气后,A中的现象是 ,整套实验装置存在的明显缺
陷是 。
②C装置中发生反应的离子方程式为 。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
查看答案和解析>>
科目:高中化学 来源:2010届湖北省高三11月月考化学测试卷 题型:实验题
(10分)以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0 mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0 mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com