
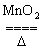 2KCl +3O2↑
2KCl +3O2↑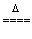 KCl+3Cl2↑+3H2O?
KCl+3Cl2↑+3H2O?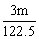 mol
mol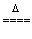 MnCl2+Cl2↑+2H2O?
MnCl2+Cl2↑+2H2O?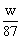 mol
mol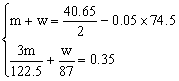
 则KClO3的分解率=
则KClO3的分解率=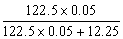 ×100%=33%.
×100%=33%.

科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.③④⑥ | C.②⑤⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
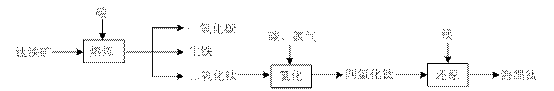
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.采用原煤脱硫技术,可减少燃煤产生的SO2 |
| B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D.工艺师利用氢氟酸刻蚀石英制作艺术品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.玛瑙的主要成分是硅酸盐 |
| B.制普通玻璃的原料是石灰石、纯碱和石英砂 |
| C.光导纤维的主要成分是晶体硅 |
| D.水晶项链、玻璃、水泥和陶瓷都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆 |
| B.用一束光线通过氯化钠溶液和蛋白质溶液,能看到相同的现象 |
| C.SO2和Cl2通入品红溶液,品红均褪色,说明两者的漂白原理相同 |
| D.浓硝酸具有强氯化性,能使铝钝化,故常用铝罐车运输冷的浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com