
���ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺��ͼ���漰����Ϊ��̬��
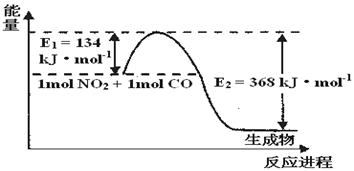
��1����ͼ��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
��2����0��5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��
![]() N2��g��+3H2��g�� 2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣
N2��g��+3H2��g�� 2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣
| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0��5 |
���ԱȽ�K1��K2�Ĵ�С��K1_ K2����д��>������=����<������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_ ___���������ĸ����
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b��v��N2����=3v��H2����
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
����400��ʱ�� �����NH3��N2��H2�����ʵ����ֱ�Ϊ1mol��2mol��3molʱ����÷�Ӧ��v��N2����_ _ v��N2��������д��>������=����<����
 ��3��һ�������£������ΪVL���ܱ������н��з�Ӧ��
��3��һ�������£������ΪVL���ܱ������н��з�Ӧ��![]()
![]()
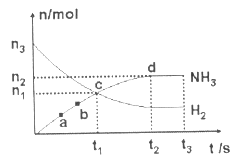
![]() ����n��H2����n��NH3����ʱ��仯�Ĺ�ϵ����ͼ������ʾ���ӿ�ʼ��ƽ��ʱ����Ӧ��ƽ��������H2��Ũ�ȱ仯��ʾΪ
����n��H2����n��NH3����ʱ��仯�Ĺ�ϵ����ͼ������ʾ���ӿ�ʼ��ƽ��ʱ����Ӧ��ƽ��������H2��Ũ�ȱ仯��ʾΪ![]() ��
��
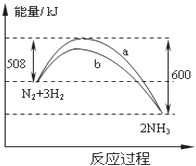
��4����һ���¶�ʱ��N2��H2��Ӧ�����������仯���������5ҳ�·���ͼ��ʾ������������ȷ���ǣ�������
A���淴Ӧ�Ļ�ܲ�С��92kJ/mol B��b�����Ǽ������ʱ�������仯����
C������������û�ѧ��Ӧ�������� D�������������������Ӧ���ʣ������淴Ӧ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����Ka��������ĵ���ƽ�ⳣ����Kb����
I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����Ka��������ĵ���ƽ�ⳣ����Kb����| ���� | ����ƽ�ⳣ����Ka�� Kb�� |
| CH3COOH | 1.8��10-5 |
| HNO2 | 4.6��10-4 |
| HCN | 5��10-10 |
| HClO | 3��10-8 |
| NH3?H2O | 1.8��10-5 |
| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����Ka��������ĵ���ƽ�ⳣ����Kb������1
| ���� | ����ƽ�ⳣ����Ka�� Kb�� |
| CH3COOH | 1.8��10-5 |
| HNO2 | 4.6��10-4 |
| HCN | 5��10-10 |
| HClO | 3��10-8 |
| NH3��H2O | 1.8��10-5 |
��ش��������⣺
��1�������������У������������� ���û�ѧʽ��ʾ����������ʹ������Һ��CH3COOH�ĵ���̶���������ƽ�ⳣ������IJ����� ������ţ���
A�������¶� B����ˮϡ�� C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ�� ��ѡ����ԡ������ԡ����ԡ����������ǣ�
��
��Һ�и�����Ũ�ȴ�С�Ĺ�ϵ�� ��
II�����ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺��ͼ���漰����Ϊ��̬��

��1����ͼ��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��
N2��g��+3H2��g��![]() 2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣
2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣
| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
���ԱȽ�K1��K2�Ĵ�С��K1_ K2����д��>������=����<������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������____���������ĸ����
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b��v��N2����=3v��H2����
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
����400��ʱ�� �����NH3��N2��H2�����ʵ����ֱ�Ϊ1mol��2mol��3molʱ����÷�Ӧ��v(N2)��_ _ v(N2)������д��>������=����<����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����Ka��������ĵ���ƽ�ⳣ����Kb������1
| ���� | ����ƽ�ⳣ����Ka�� Kb�� |
| CH3COOH | 1.8��10-5 |
| HNO2 | 4.6��10-4 |
| HCN | 5��10-10 |
| HClO | 3��10-8 |
| NH3��H2O | 1.8��10-5 |
��ش��������⣺
��1�������������У������������� ���û�ѧʽ��ʾ����������ʹ������Һ��CH3COOH�ĵ���̶���������ƽ�ⳣ������IJ����� ������ţ���
A�������¶� B����ˮϡ�� C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ�� ��ѡ����ԡ������ԡ����ԡ����������ǣ�
��
��Һ�и�����Ũ�ȴ�С�Ĺ�ϵ�� ��
II�����ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺��ͼ���漰����Ϊ��̬��

��1����ͼ��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��
N2��g��+3H2��g��![]() 2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣
2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣
| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
���ԱȽ�K1��K2�Ĵ�С��K1_ K2����д��>������=����<������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������____���������ĸ����
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b��v��N2����=3v��H2����
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
����400��ʱ�� �����NH3��N2��H2�����ʵ����ֱ�Ϊ1mol��2mol��3molʱ����÷�Ӧ��v(N2)��_ _ v(N2)������д��>������=����<����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�������ʡ����������ѧ���������νλ�ѧ�Ծ����������� ���ͣ������
��12�֣�I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����Ka��������ĵ���ƽ�ⳣ����Kb������1
| ���� | ����ƽ�ⳣ����Ka�� Kb�� |
| CH3COOH | 1��8��10-5 |
| HNO2 | 4��6��10-4 |
| HCN | 5��10-10 |
| HClO | 3��10-8 |
| NH3��H2O | 1��8��10-5 |

 2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣
2NH3��g����H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⡣| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0��5 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com