
分析 (1)依据氯和氢氧化钠反应的化学方程式分析判断,还原产物为氢气;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度;铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子分析书写离子方程式.
解答 解:(1)发生2Al+2NaOH+6H2O=2NaAlO2+3H2↑+4H2O,还原产物为氢气,当反应转移6mol电子时,所得还原产物的物质的量为3mol;
故答案为:3;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+;
故答案为:bd;不能;Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+.
点评 本题考查了铝热反应原理分析,氧化还原反应电子转移计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
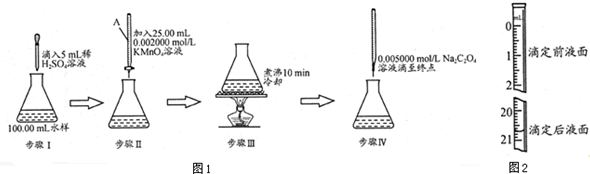
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 铜片与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氨水与稀醋酸反应:OH-+H+═H2O | |
| D. | 铁片与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、S2- | ||
| C. | NH4+、Mg2+、SO42-、NO3- | D. | H+、K+、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 若为电解饱和食盐水的装置,则a,b上均产生气体 | |
| B. | 若为工业冶炼铝的装置,则用熔融氯化铝作电解液 | |
| C. | 若为工业制钠的装置,则钠在a上生成 | |
| D. | 若利用该装置回收氯化铜溶液中的铜,则a不能是铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
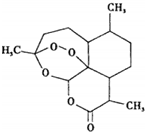 2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )
2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )| A. | 青蒿素化学式为C15H20O5 | B. | 在光照条件下可能发生取代反应 | ||
| C. | 可以与氢气发生加成反应 | D. | 水浸青蒿对治疗疟疾有良好的疗效 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com