
【题目】已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 molL﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( ) 
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10﹣5 molL﹣1s﹣1
C.图中b、c两点对应的NaHSO3反应速率相等
D.40℃之后,淀粉不宜用作该实验的指示剂
【答案】C
【解析】解:A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2 , 故A正确;
B.a点时间为80s,浓度变化量为 ![]() =0.004mol/L,a点对应的NaHSO3反应速率为5.0×10﹣5molL﹣1s﹣1 , 故B正确;
=0.004mol/L,a点对应的NaHSO3反应速率为5.0×10﹣5molL﹣1s﹣1 , 故B正确;
C.b点的反应原理为:当碘酸钾过量时,生成碘单质,其离子反应式为5SO32﹣+2IO3﹣+2H+=5SO42﹣+I2+H2O,而图中c点的反应原理为2IO3﹣+5SO2+4H2O=5SO42﹣+I2+8H+ , 则图中b、c点对应的反应原理不一样,且温度不同,故反应速率不同,故C错误;
D.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,故D正确.
故选C.
A.由图可知,40℃之前,温度高反应速率加快,40℃之后温度高,变色时间越长;
B.a点时间为80s,浓度变化量为 ![]() =0.004mol/L;
=0.004mol/L;
C.b、c点对应的反应原理及温度不同;
D.结合55℃时,没有出现蓝色分析.


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A.
表示10 mL 0.01molL﹣1KMnO4酸性溶液与过量的0.1molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
B.
表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.
表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
D.
表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某温度下,Ksp(AgCl)=1.8×10﹣10 , Ksp (Ag2CrO4)=1.9×10﹣12 , 故Ag2CrO4更难溶
B.在CaCO3饱和溶液中,加入CaCl2固体,沉淀溶解平衡逆向移动,溶液中Ca2+浓度减小
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.在AgCl饱和溶液中,加入AgCl固体,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3在化学定量分析中常用作基准物质,遇酸易分解;实验室制备原理为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2 . 实验装置如下:
3Na2S2O3+CO2 . 实验装置如下: 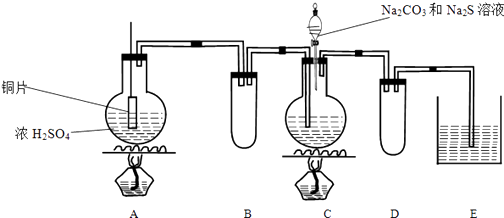
(1)A中发生反应的化学方程式是: .
(2)E中所盛试剂作用是;若要停止A中的化学反应,还可以采取的操作是 .
(3)B和D装置作用:
(4)甲同学在加热A后,发现液面下的铜丝变黑.该同学对黑色生成物提出如下假设:
①可能是CuO;②可能是Cu2O;③可能是CuS
乙同学认为假设②一定不成立,依据是 .
该同学设计实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为(填化学式) .
(5)C中通入SO2不能过量原因是 .
(6)实验室用硫代硫酸钠溶液吸收残余氯气生成SO42﹣ , 其反应的离子方程式是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代我国沿海居民利用海水制食盐,把海水引入盐田,利用日光、风力蒸发浓缩海水,使其达到饱和进一步使食盐结晶出来,这种方法在化学上称为 ( )
A. 蒸馏 B. 冷却结晶 C. 重结晶 D. 蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A,B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( ) 
A.A,B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若a小于5,则A,B都是弱酸,且A的酸性弱于B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用.
I.氧化物﹣Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
已知:HCl(浓)+FeCl3HFeCl4 . 试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca2+、Mn2+、Cu2+等杂质离子主要在(填“水”或“有机”)相.
②若实验时共用萃取剂X 150mL,萃取率最高的方法是(填字母).
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是(写化学式);反萃取能发生的原因是 .
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是 .
(4)测定产品中铁的含量需经酸溶、还原为Fe2+ , 然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+ , 写出该滴定反应的离子方程式 .
(5)II.含氧酸盐﹣铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用.在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4﹣a),氧缺位值(a)越大,活性越高,制氢越容易.
根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式 .
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=(结果保留小数点后2位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是( )
A.该反应的△H<0,△S>0
B.途径Ⅱ与途径I相比,可能是加了催化剂
C.其他条件相同时,产生相同体积的氧气时放出的热量:途径I>途径Ⅱ
D.其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com