
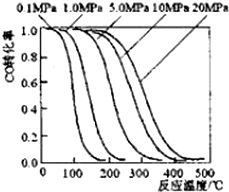
 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )| A. | 旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应 | |
| B. | 旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势 | |
| C. | 新法与旧法相比,反应更困难 | |
| D. | 新法生产中,需控制V(CH4)/V(O2)=9:1,目的是提高空气中氧气的转化率 |
分析 由图象可以看出,温度升高,CO的转化率降低,说明CO+2H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3OH为放热反应,升高温度平衡向逆反应方向移动,而在相同温度下,增大压强CO的转化率增大,但在较低的压强下,CO的转化率非常高,无需高压,新法使用甲烷为原料,可直接从天然气中获得,原料比较丰富,更具有优势.
解答 解:A.由图象可以看出,温度升高,CO的转化率降低,升高温度平衡向逆反应方向移动,CO与H2合成甲醇的反应是放热反应,故A正确;
B.在较低的压强下,CO的转化率非常高,无需高压,并且高压对设备的有更高的要求,故B错误;
C.新法使用甲烷为原料,可直接从天然气中获得,原料比较丰富,更具有优势,故C错误;
D.根据反应方程式2CH4+O2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2CH30H可知,当V(CH4):V(02)>2:1时,将使CH4的转化率低于氧气的转化率,故D错误.
故选A.
点评 本题考查化学平衡图象问题,题目难度中等,注意把握图象曲线的变化特点,根据温度对平衡移动的影响判断反应放热.


科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿内加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 加入试剂的顺序为Na2CO3、BaCl2、NaOH、HCl | |
| D. | 用过滤法除去粗盐中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
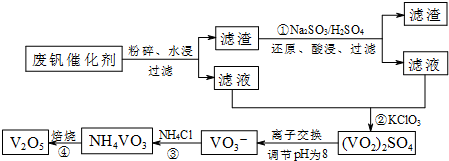
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与5molH2发生反应 | |
| B. | 1mol胡椒酚最多可与4mol溴发生反应 | |
| C. | 胡椒酚中所有原子可以共平面 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 试剂A可以是稀硫酸或盐酸 | |
| B. | 加入试剂B除去Mg2+、Fe3+ | |
| C. | 滤渣1的主要成分是SiO2 | |
| D. | 电解氧化铝时在阴极上定期补充炭块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 抗酸药能中和胃里过多的盐酸,缓解胃部不适,是一类治疗胃痛的药 | |
| B. | 碳酸镁、碳酸钡都能制成抗酸药 | |
| C. | 青霉素有阻止多种细菌生长的优异功能,虽经1×107 倍稀释,仍有疗效 | |
| D. | 青霉素是重要的消炎药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com