
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 人体缺乏铁元素,可以补充硫酸亚铁,且多多益善 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 |
分析 A.添加剂可限量添加,过量使用有害;
B.雾霾所形成的气溶胶为胶体分散系;
C.铁在人体中属于微量元素,人体内铁过量,也会引起各种疾病;
D.屠呦呦对青蒿素的提取,为萃取原理.
解答 解:A.添加剂可限量添加,过量使用有害,则含有添加剂的食物不超标时,能食用,故A错误;
B.雾霾所形成的气溶胶为胶体分散系,具有丁达尔效应,故B正确;
C.铁在人体中属于微量元素,人体内铁过量,也会引起各种疾病,则人体缺乏铁元素,可以补充硫酸亚铁,不是多多益善,应适量,故C错误;
D.屠呦呦对青蒿素的提取,为萃取原理,为物理变化,故D错误;
故选B.
点评 本题考查物质的组成和性质,为高频考点,把握物质的性质、化学与生活的联系为解答的关键,侧重分析与应用能力的考查,注意化学与人类健康的关系,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 测中和热 | 向沸水中滴加FeCl3饱和溶液,在加热到出现红褐色沉淀,即制得Fe(OH)3胶体 | 实验室原油蒸馏 | 吸收CO2中的HCl杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,10g46%的CH3CH2OH溶液中所含有的氧原子数为0.4NA | |
| B. | 向FeI2溶液中通人适量的Cl2,当有1molFe2+被氧化时,共转移电子数目为3NA | |
| C. | 在标准状况下,将11.2LHCl溶于1L水中,溶液中HCl分子数为0.5NA | |
| D. | 常温常压下,0.1molNaHSO4晶体中,含有阴阳离子数共0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2mol/L 时,溶液的pH=9 | |
| C. | 滴加过程中,当溶液的pH=7 时,溶液中2c(NH4+)=c(SO42-) | |
| D. | 若滴加pH=11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

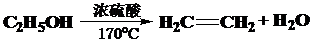 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种元素组成的晶体一定只含极性键 | |
| B. | 离子晶体一定不含非极性键 | |
| C. | 原子晶体一定含有共价键 | |
| D. | 分子晶体一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
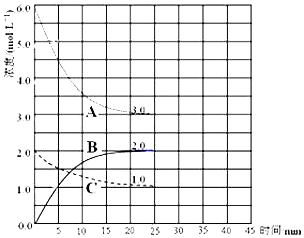

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com