
将a mol  和1mol
和1mol
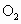 置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101kPa),在120℃下测得反应前后容器内气体的密度分别为
置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101kPa),在120℃下测得反应前后容器内气体的密度分别为 和
和 .若a的取值不同,则
.若a的取值不同,则 的氧化产物可能有如下三种情况:
的氧化产物可能有如下三种情况:
(1)全部是 ,此时a的取值范围是________(写出分析过程).
,此时a的取值范围是________(写出分析过程).
(2)全部是S,此时a的取值范围是________,并且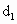 ________(填“大于”、“小于” 或“等于”)
________(填“大于”、“小于” 或“等于”) .
.
(3)部分是 ,部分是S,此时a的取值范围是________.反应所生成的
,部分是S,此时a的取值范围是________.反应所生成的 的物质的量为________mol.容器内气体的物质的量之和为________mol(以含a的代数式表示).
的物质的量为________mol.容器内气体的物质的量之和为________mol(以含a的代数式表示).
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编:化学反应速率 题型:022
“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
(1)下列措施中,有利于降低大气中CO2浓度的有:________.(多选,填字母)
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6
C6H12O6
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2
CH2![]() CH2+4H2O
CH2+4H2O
以上反应中,最节能的是________,原子利用率最高的是________.
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
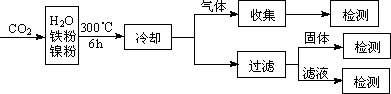
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.
CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
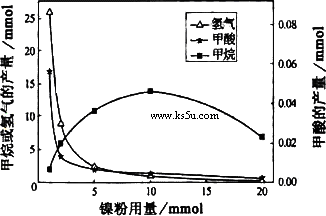
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即:CO2![]() HCOOH
HCOOH![]() CH4
CH4
①写出产生H2的反应方程式________.
②由图可知,镍粉是________.(填字母)
A.反应的催化剂
B.反应的催化剂
C.反应的催化剂
D.不是催化剂
③当镍粉用量从1m mol增加到10m mol,反应速率的变化情况是________.(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应ⅠⅡ的速率均不变
d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快
e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)C元素在周期表中的位置是___________________;C在A中燃烧形成的固体中阴阳离子的数目比为_____________;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为_____________________________________________________。
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且物质的量浓度相等的M、N溶液中水的电离程度,前者小于后者。则M、N分别为_______(填化学式);若将0.1 mol·L-1M和0.2 mol·L-1N两溶液等体积混合,所得溶液中离子浓度的大小顺序为_____________。
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(一)(解析版) 题型:解答题
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.| A | B | C | D | |
| Ⅰ | 0.05mol?L-1 | a mol?L-1 | 0.05mol?L-1 | b mol |
| Ⅱ | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 | m mol |
| Ⅲ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 | n mol |
| Ⅳ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 | p mol |
查看答案和解析>>
科目:高中化学 来源:2011年河北省衡水市冀州中学高考化学模拟试卷(4月份)(解析版) 题型:选择题
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.| A | B | C | D | |
| Ⅰ | 0.05mol?L-1 | a mol?L-1 | 0.05mol?L-1 | b mol |
| Ⅱ | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 | m mol |
| Ⅲ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 | n mol |
| Ⅳ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 | p mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com