
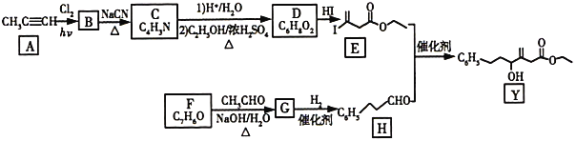
【题目】近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
已知:RCHO+CH3CHO![]() RCH=CHCH3+H2O
RCH=CHCH3+H2O
回答下列问题:
(1)A的化学名称是__________;状态__________。
(2)B为单氯代烃,分子式为C3H3Cl,由B生成C的反应类型 __________。
(3)A中少一个碳原子的有机物结构简式__________;实验室制备该气体化学方程式__________ 。
(4)E的分子式为__________。
(5)Y中含氧官能团的名称为__________。
(6)X与H互为同分异构体,写出一种符合条件的X的结构简式__________。
①具有完全相同官能团; ②苯环上有2个取代基;
【答案】丙炔 气体 取代反应 CH≡CH CaC2+2H2O→C2H2↑+Ca(OH)2 C6H9O2I 羟基、酯基 ![]()
【解析】
丙炔和氯气在光照下发生甲基上的取代反应生成单氯代烃B,所以B的结构简式为CH≡C-CH2Cl,B生成C是B分子中的Cl被-CN取代,C的结构简式为CH≡C-CH2CN,C生成D的第一步是C中的-CN水解为-COOH,第二步是和乙醇发生酯化反应生成酯,D的结构简式为CH≡C-CH2-COOC2H5,D和HI发生加成生成E(![]() )。根据给出的信息,结合F的分子式,可知F为苯甲醛,和乙醛发生反应生成G(
)。根据给出的信息,结合F的分子式,可知F为苯甲醛,和乙醛发生反应生成G(![]() ),G和H2加成生成H,H和E发生反应生成Y。
),G和H2加成生成H,H和E发生反应生成Y。
由以上分析可知:
(1)A的化学名称是丙炔;碳原子数在4以及4以下的烃在常温下均为气态,丙炔只有3个碳原子,所以常温下为气体。
(2)B为单氯代烃,分子式为C3H3Cl,由B生成C的反应类型为取代反应。
(3)A为丙炔,比A少一个碳原子的有机物为乙炔,结构简式为CH≡CH;实验室用电石和水(通常用饱和食盐水代替水以减慢反应速率)制备乙炔,化学方程式为CaC2+2H2O→C2H2↑+Ca(OH)2。
(4)E的结构简式为![]() ,分子式为C6H9O2I。
,分子式为C6H9O2I。
(5)Y的结构简式为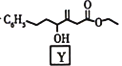 ,其中含氧官能团为酯基和羟基。
,其中含氧官能团为酯基和羟基。
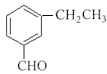
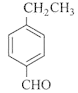
(6)H的分子式为C9H10O,官能团为醛基,X与H互为同分异构体,要求①和H具有完全相同官能团,即分子中有醛基;②苯环上有2个取代基。苯环上连有3个碳原子,其中一个是醛基碳原子。则苯环上的两个取代基可以分别是-CHO和-C2H5、-CH2CHO和-CH3,所以有![]() 、
、 、
、 、
、![]() 、
、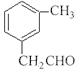 、
、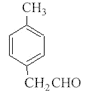 ,任写一种。
,任写一种。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氧化锌为白色固体,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是 MnO2。回答下列问题:
(1)为加快步骤①的浸取速率,下列措施中无法达到目的是_____(填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌
d.适当增加硫酸浓度 e.适当升高温度
(2)反应②中除掉的杂质离子是_____(填离子符号),发生反应的离子方程式为:_____。
(3)加入高锰酸钾溶液前,若 pH 较低,对除杂的影响是_____。
(4)步骤③过滤得到的滤渣中,除了过量的锌外还有_____。
(5)反应④中产物的成分可能是 ZnCO3xZn(OH)2。取干燥后的滤饼 11.2 g,煅烧后可得到产品 8.1 g,则 x=_____(ZnCO3、Zn(OH)2 的相对分子质量分别为:125、99)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)固态 CO2(干冰)所属晶体类型___________,所含化学键类型为__________(填“非极性键”或“极性键”或“离子键,下同)。CO2与Na2O2反应过程形成化学键类型为______________________________。
(2)中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。
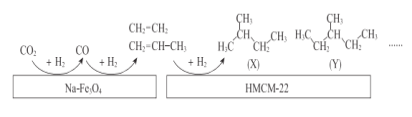
①Na-Fe3O4和HMCM-22 在反应中的作用为_______________。
②写出(X)的所有同分异构体结构简式_______________。
③关于X与Y的说法正确的是__________(填序号〕。
a.最简式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.X与Y互称同系物
(3)同温同压下,蒸气密度是氢气15倍的烷烃(M),写出其与氯气反应生成一氯代烃的方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
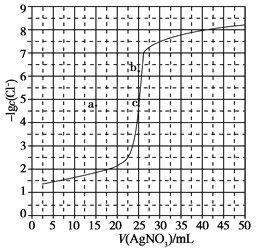
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年政府工作报告提出要持续开展大气污染的治理攻坚。下列与大气污染防治无关的是
A.海水晒盐
B.汽车尾气净化减排
C.工业尾气回收处理
D.利用清洁能源替代化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,C和H2O(g)在密闭容器里发生下列反应:
①C(s)+H2O(g)![]() CO(g)+H2(g), ②CO(g)+H2O(g)
CO(g)+H2(g), ②CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1。则下列叙述正确的有
A. CO在平衡时转化率为10%
B. 平衡浓度c(CO2)=c(H2)
C. 平衡时气体平均相对分子质量约为23.3
D. 其他条件不变时,缩小体积,H2O(g)的转化率随之降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高中科研小组模拟工业尿素法生产肼(N2H4),具体方法:先将尿素、次氯酸钠和氢氧化钠溶液混合,然后在催化剂存在的条件下反应制得肼,利用氮气吹出混合物中的肼,并用硫酸吸收制备硫酸肼。具体实验原理图如下:
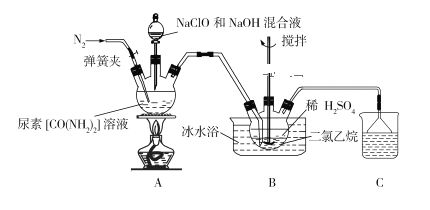
已知:①肼极易溶于水,长期暴露在空气中或短时间受高温作用会爆炸分解。
②硫酸肼(N2H4·H2SO4)是类似于NH4HSO4的盐类,白色固体,微溶于冷水,易溶于热水,不溶于乙醇和二氯乙烷等有机溶剂。
③密度:ρ硫酸肼>ρ二氯乙烷>ρ稀硫酸
(1)盛装尿素溶液的装置名称为_____________________;硫酸肼的水溶液中含有多种阳离子,其中阳离子N2H5+的电子式为________________________。
(2)反应前应先通入一段时间氮气,其目的为________________________________。
(3)装置A中发生反应制备肼的离子方程式为_______________________________。
(4)装置B中二氯乙烷的作用为__________________________________________;使用冰水浴的作用__________________________________________________。
(5)装置B反应完全后需经过过滤、洗涤、干燥等操作得到硫酸肼,洗涤过程中最好选择下列那种洗涤剂________________(填字母)。
A.冷水 B.热水 C.无水乙醇 D.饱和食盐水
(6)若实验中所用的NaClO和NaOH混合液中两溶质的浓度均为0.1mol·L1,则此溶液中离子浓度的大小顺序为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g)+I2(g)2HI(g)在一定的条件下反应混合物中各组分的浓度(mol·L-1)与时间t(min)的变化曲线如图所示,根据图示,回答
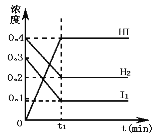
(1)时间t1的意义是_________
(2)在时间0至t1的间隔里,v(H2) =________________
(3)此平衡状态下,H2的转化率为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com