
 请按要求回答下列问题:
请按要求回答下列问题: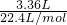 =0.15mol,转移的电子数目为:2Al~3H2~6e-,计算得到0.15mol氢气生成单质转移0.3mol,电子数为0.3NA,
=0.15mol,转移的电子数目为:2Al~3H2~6e-,计算得到0.15mol氢气生成单质转移0.3mol,电子数为0.3NA,

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
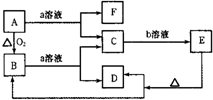 请按要求回答下列问题:
请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
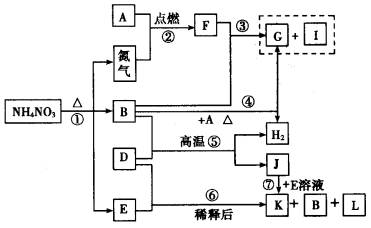
请回答:
(1)构成单质D的元素在周期表中处于________周期、________族.
(2)I物质的电子式为________,F物质的化学式为________,它们的晶体类型分别为________________.
(3)写出下列反应的化学方程式③__________________,⑤_____________________.
(4)在反应⑤中如果有2molJ物质生成,则反应中转移的电子为________mol.
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2009-2010学年河南省许昌市高三(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com