
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | C6H6十Br2$\stackrel{Fe}{→}$C6H5Br+HBr | |
| C. | CH2═CH2+Br2CH2Br-CH2Br | |
| D. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH3+H2O |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
常见能发生加成反应的物质往往含有C=C、C≡C、C=O等官能团,以此解答该题.
解答 解:A.甲烷在光照条件下与氯气发生取代反应,故A错误;
B.C6H6十Br2$\stackrel{Fe}{→}$C6H5Br+HBr是苯分子中的一个氢原子被溴原子代替,属于取代反应,故B错误;
C.乙烯含有碳碳双键,可与溴水发生加成反应1,2-二溴乙烷,故C正确;
D.乙酸、乙醇发生酯化反应生成乙酸乙酯,也为取代反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,侧重于有机物反应类型的判断,注意把握有机物的官能团的性质以及转化,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+ | B. | Mg2+、Fe2+ | C. | NH4+、Fe2+ | D. | Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | O═O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
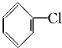 制取
制取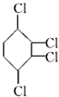 ,其合成流程如下:
,其合成流程如下:
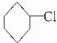 .
. ,
,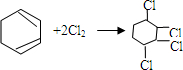 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
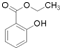 )广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下:
)广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下: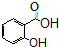 +C2H5OH?
+C2H5OH?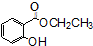 +H2O
+H2O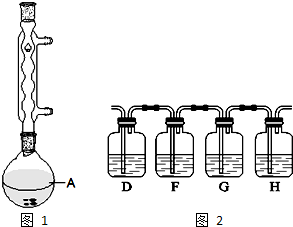
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
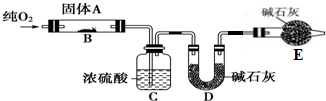
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com