
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用Ba( NO3)2溶液鉴别Cl-、$SO_4^{2-}$和$CO_3^{2-}$ | |
| C. | 用核磁共振氢谱鉴别l-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO |
分析 A.均与氨水反应生成白色沉淀;
B.只有氯离子不与硝酸钡反应;
C.1-溴丙烷中三种峰面积之比为3:2:2,2-溴丙烷中两种峰面积之比为3:1;
D.碳碳双键、-OH、-CHO均能被高锰酸钾氧化.
解答 解:A.均与氨水反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.只有氯离子不与硝酸钡反应,硫酸根离子、碳酸根离子均与钡离子反应生成白色沉淀,现象相同,不能鉴别,故B错误;
C.1-溴丙烷中三种峰面积之比为3:2:2,2-溴丙烷中两种峰面积之比为3:1,则用核磁共振氢谱鉴别l-溴丙烷和2-溴丙烷,故C正确;
D.碳碳双键、-OH、-CHO均能被高锰酸钾氧化,用KMnO4酸性溶液不能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO,故D错误;
故选C.
点评 本题考查物质的鉴别及检验,为高频考点,把握物质的性质与性质差异、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
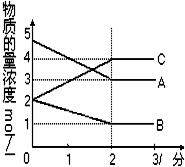 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示 2C.
2C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C的化学式为Mg(OH)2
,C的化学式为Mg(OH)2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ⑤②①③④ | D. | ④①②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$ mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变 | |
| D. | 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com