
(12分) X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。 请回答下列问题:
(1)X元素的名称是________________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________。
(3)写出F的电子式______________________________。
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式___________, ;
B中含有的化学键是 ;请举一例说明B的用途_____________。
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
(1)钠 (2) Na>O>H (3)
(4)2Na+2H2O=4NaOH+H2↑;2Na2O2+2H2O=4NaOH+O2↑;离子键和非极性键;作呼吸面具和潜水艇里氧气得来源 (5)2H2O2 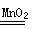 2H2O+O2
2H2O+O2
【解析】
试题分析:(1)B为淡黄色固体可推测为Na2O2,三种元素中有Na和O。C、E常温为液体,推测为H2O2和H2O,可知三种元素还包括H。A为XZ的离子化合物,可知A为NaH,X为Na,Y为O,Z为H.则A为NaH,B为Na2O2,C为H2O2,D为Na2O,E为H2O,F为NaOH.故X元素的名称是:钠。(2)同周期从左到右半径逐渐减小,同主族从上到下逐渐增大,X、Y、Z的原子半径从大到小的顺序是(用元素符号表示):Na>O>H。
(3)F的化学式:NaOH,F的电子式: 。
。
(4)X为Na,B为Na2O2,E为H2O,X单质、B分别与E反应的化学方程式:2Na+2H2O=4NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑,B是过氧化钠,含有钠离子和过氧根离子.故含离子键,过氧根离子内两个氧原子间是非极性键。
(5)C为H2O2,Y为O,反应的化学方程式:2H2O2 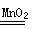 2H2O+O2↑。
2H2O+O2↑。
考点:考查元素周期表,原子结构,元素及其化合物的性质,化学键


科目:高中化学 来源:2013-2014黑龙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.乙醇分子中的氢原子均可被金属钠置换
B.烃分子中的氢原子被羟基取代后的衍生物都属于醇
C.甲醇是最简单的醇,它不能发生消去反应生成烯烃
D.某一元醇在浓硫酸存在下加热到170℃可以生成丙烯,该一元醇一定是1-丙醇
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
氢能是理想的清洁能源。下列制氢的方法中,最节能的是
A.电解水制氢:2H2O电解2H2↑+O2↑
B.高温使水分解制氢:2H2O高温2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O高温CO+3H2
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高二下学期期末考试化学试卷(解析版) 题型:选择题
已知酸性: 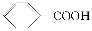 >H2CO3>
>H2CO3> 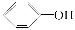 ,综合考虑反应物的转化率、原料成本、操作是否简便等因素,将
,综合考虑反应物的转化率、原料成本、操作是否简便等因素,将 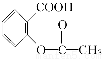 转变为
转变为 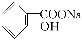 的最佳方法是( )
的最佳方法是( )
A.与稀H2SO4共热后,加入足量的NaOH溶液
B.与稀H2SO4共热后,加入足量的Na2CO3溶液
C.与足量的NaOH溶液共热后,再通入足量CO2
D.与足量的NaOH溶液共热后,再加入适量H2SO4
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是( )
① C与O2 ② Na与O2 ③ Fe与Cl2 ④ AlCl3溶液与氨水
⑤ CO2与NaOH溶液 ⑥ Cu与硝酸 ⑦ AgNO3溶液与氨水
A.除③外 B.除③⑦外 C.除③④外 D.除⑥⑦外
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:选择题
abcd是四种短周期元素。a、b、d同周期,c、d同主族.a原子结构示意图 ,b与c形成化合物的电子式为如图
,b与c形成化合物的电子式为如图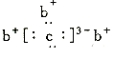 。下列比较中正确的是
。下列比较中正确的是
A.原子半径:a >c>d B.非金属性:a >b>d
C.单质的熔点:c> a D.最高价氧化物对应的水化物的酸性:c>d>a
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:选择题
恒温恒容的容器内,不可作为可逆反应I2(g)+H2(g) 2HI(g)达到平衡状态的标志的是
2HI(g)达到平衡状态的标志的是
A.1 mol H—H键断裂,同时有2 mol H—I键断裂 B.容器内气体的总压强不再变化
C.H2的物质的量浓度不再变化 D.混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源:2013-2014青海西宁五中片区大联考高三5月高考模拟理综化学试卷(解析版) 题型:实验题
(15分)【化学——化学与技术】
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。

请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是__________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________。(空气中氧气的体积分数按0.2计),该尾气的处理方法是____________________________________________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式__________________________________________、______________________________、___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:选择题
设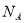 表示阿伏加德罗常数,下列叙述中正确的是
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P—P键数为NA
②. 1mol CH3+(碳正离子)中含有电子数为10NA
③. 1mol铜与足量硫蒸气反应,转移电子数为2NA
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子
⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA
⑥.0.84 g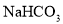 晶体中阳离子和阴离子总数为0.03NA
晶体中阳离子和阴离子总数为0.03NA
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com