
【题目】为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间
A. ①②③⑥ B. ①③④⑤ C. ③④⑤⑥ D. 全部
科目:高中化学 来源: 题型:
【题目】碱金属是典型的活泼金属,其根本原因是 ( )
A. 碱金属原子最外电子层上都只有1个电子,容易失去
B. 碱金属在常温下易被氧化
C. 碱金属单质的密度小,熔点和沸点低
D. 碱金属原子的核电荷数比较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3物质的量浓度分别为0.1 mol/L和0.3 mol/L,则10 min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率 B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率 D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO3为0.4 mol/L D.SO2、SO3均为0.15 mol/L
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子或原子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6B.O2-:1s22s22p4
C.K: 1s22s22p63s23p64s1D.Fe3+:1s22s22p63s23p63d5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 葡萄糖的分子式C6H12O6 B. 苯的分子式CH
C. 乙酸的结构简式CH3CH2OH D. 乙烷的结构简式C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
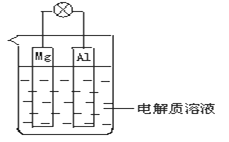
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”或“不亮”)。若灯泡亮,则Mg电极上发生的反应为:______;Al电极上发生的反应为:______。若灯泡不亮,其理由为:________________。
(2)电解质溶液为NaOH(aq)时,灯泡______(填“亮”或“不亮”)。若灯泡亮,则Mg电极上发生的反应为:______;Al电极上开始时发生的反应为:______。若灯泡不亮,其理由为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Cu—Zn—稀H2SO4构成的原电池装置中,当导线中有1mol电子通过时,理论上两极的变化是
①锌片溶解了32.5g ②锌片增重32.5g③铜片上析出1g H2 ④铜片上析出1mol H2
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是( )
A. 1 L生理盐水(0.9%NaCl溶液)中含有9 molNa+
B. 出土的古代铜制品表面覆盖着铜绿,其主要成分是CuO
C. 装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低
D. 节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com