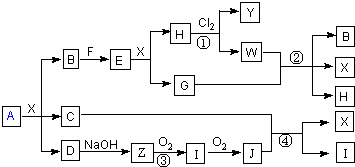
解:B、F为固态单质,其余为化合物,B呈黄色,则B为S,F为Fe,E为FeS,X应为H
2SO
4,所以H为FeCl
2,G是气体,G为H
2S,反应①为硫酸亚铁与氯气的反应,生成氯化铁和硫酸铁,所以Y、W的阳离子相同,均含有Fe
3+,反应②为硫酸亚铁与硫化氢反应,生成B(S)、X(H
2SO
4)、H(FeSO
4);D与碱反应生成Z,能发生连续氧化,则Z为NH
3,D为(NH
4)
2SO
4,I为NO,J为NO
2,C为气体,C应为SO
2,反应④为二氧化硫、二氧化氮在水中反应生成X(硫酸)和I(NO),由两种正盐组成的混合物A,与硫酸反应生成S、SO
2、(NH
4)
2SO
4,则A为(NH
4)
2S、(NH
4)
2SO
3,
(1)A为(NH
4)
2S、(NH
4)
2SO
3,故答案为:(NH
4)
2S;(NH
4)
2SO
3;
(2)反应①为硫酸亚铁与氯气的反应,离子反应为2Fe
2++Cl
2=2Fe
3++2Cl
-,故答案为:2Fe
2++Cl
2=2Fe
3++2Cl
-;
(3)反应②为硫酸亚铁与硫化氢反应,离子反应为2Fe
3++H
2S=S↓+2Fe
2++2H
+,故答案为:2Fe
3++H
2S=S↓+2Fe
2++2H
+;
(4)反应③为氨气的催化氧化反应,该反应为4NH
3+5O
2
4NO+6H
2O,故答案为:4NH
3+5O
2
4NO+6H
2O;
(5)反应④为二氧化硫、二氧化氮在水中反应生成X(硫酸)和I(NO),该反应为NO
2+SO
2+H
2O=H
2SO
4+NO,故答案为:NO
2+SO
2+H
2O=H
2SO
4+NO;
(6)D中阳离子为铵根离子,取样品D于试管中,加入NaOH溶液,加热.用湿润的红色石蕊试纸在试管口检验,若红色石蕊试纸变蓝,说明有NH
4+,
故答案为:取样品D于试管中,加入NaOH溶液,加热.用湿润的红色石蕊试纸在试管口检验,若红色石蕊试纸变蓝,说明有NH
4+;
(7)Y溶液滴入沸水可得到红褐色液体,发生Fe
3++3H
2O

Fe(OH)
3(胶体)+3H
+,生成胶体,具有丁达尔现象、电泳、聚沉的性质,而将该液体加热、蒸干、灼烧后,最终为氧化铁,则选abc,故答案为:Fe
3++3H
2O

Fe(OH)
3(胶体)+3H
+;abc.
分析:B、F为固态单质,其余为化合物,B呈黄色,则B为S,F为Fe,E为FeS,X应为H
2SO
4,所以H为FeCl
2,G是气体,G为H
2S,反应①为硫酸亚铁与氯气的反应,生成氯化铁和硫酸铁,所以Y、W的阳离子相同,均含有Fe
3+,反应②为硫酸亚铁与硫化氢反应,生成B(S)、X(H
2SO
4)、H(FeSO
4);D与碱反应生成Z,能发生连续氧化,则Z为NH
3,D为(NH
4)
2SO
4,I为NO,J为NO
2,C为气体,C应为SO
2,反应④为二氧化硫、二氧化氮在水中反应生成X(硫酸)和I(NO),由两种正盐组成的混合物A,与硫酸反应生成S、SO
2、(NH
4)
2SO
4,则A为(NH
4)
2S、(NH
4)
2SO
3,然后结合物质的性质来解答.
点评:本题考查无机物的推断,明确物质的状态和颜色确定S、Fe为突破口,再结合反应②③推断出各物质是解答本题的关键,注意X为硫酸而不是盐酸为解答的难点,题目难度较大.


 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O; Fe(OH)3(胶体)+3H+,生成胶体,具有丁达尔现象、电泳、聚沉的性质,而将该液体加热、蒸干、灼烧后,最终为氧化铁,则选abc,故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+,生成胶体,具有丁达尔现象、电泳、聚沉的性质,而将该液体加热、蒸干、灼烧后,最终为氧化铁,则选abc,故答案为:Fe3++3H2O Fe(OH)3(胶体)+3H+;abc.
Fe(OH)3(胶体)+3H+;abc.

 阅读快车系列答案
阅读快车系列答案