
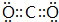 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为 .
. .
.分析 有A、B、C、D四种短周期元素,原子序数依次增大.A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,据此解答.
解答 解:有A、B、C、D四种短周期元素,原子序数依次增大.A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素.
(1)通过以上分析知,A是碳,C是钠,D是硫,故答案为:碳;钠;硫;
(2)B为氧元素,处于周期表中第二周期VIA族,故答案为:二;VIA;
(3)CO2分子中碳原子与氧原子形成2对共用电子对,电子式为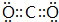 ,C 单质在高温下与B单质充分反应所得化合物为Na2O2,电子式为
,C 单质在高温下与B单质充分反应所得化合物为Na2O2,电子式为 ,
,
故答案为: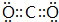 ;
; ;
;
(4)C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为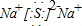 ,用电子式表示其形成过程为:
,用电子式表示其形成过程为: ,
,
故答案为: ;
;
(5)一般情况下,碳元素与氢元素形成的化合物是以极性键结合的化合物,
故答案为:极性.
点评 本题考查结构性质位置关系应用,侧重对电子式的考查,注意掌握电子式表示化学键或物质的性质过程.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温下一定能发生反应 | |
| C. | 放热反应不需要加热就能发生 | |
| D. | 吸热反应在常温下也能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

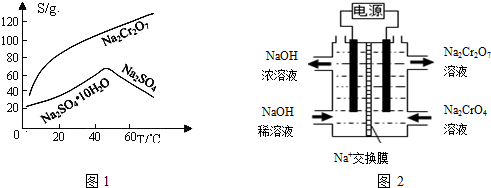
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )
) .由甲苯生成甲的反应类型是取代反应.
.由甲苯生成甲的反应类型是取代反应. +HOCH2CH2Cl$→_{△}^{浓硫酸}$
+HOCH2CH2Cl$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇到苯酚显紫色的溶液:SCN-、Na+、SO32-、Cl- | |
| B. | 含有Na2CO3的溶液:Al3+、Ca2+、Cl-、NO3- | |
| C. | 通入足量CO2的溶液:K+、SiO32-、Cl-、NO3- | |
| D. | 25℃时pH<7的溶液:K+、Cu2+、Fe3+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com