
| A. | pH=5的H2S溶液中:c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 将0.01 mo1•L-1的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c(Cl-) | |
| C. | 在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mo1•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+) |
分析 A.根据H2S溶液中的电荷守恒判断;
B.反应后生成氯化铵,铵根离子部分水解,则c(NH4+)<c(Cl-);
C.根据碳酸钠溶液中的质子守恒判断;
D.醋酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-).
解答 解:A.pH=5的H2S溶液中,根据电荷守恒可知:c(H+)=1×10-5mol•L-1=c(HS-)+c(OH-)+2c(S2-),故A错误;
B.将0.01 mo1•L-1的盐酸与0.01 mo1•L-1氨水等体积混合,二者恰好反应生成氯化铵,由于铵根离子部分水解,导致铵根离子浓度减小,则c(NH4+)<c(Cl-),故B错误;
C.碳酸钠溶液中存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),则c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故C错误;
D.0.1 mo1•L-1CH3COONa溶液中,CH3COO-部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、质子守恒的含义为解答关键,注意掌握盐的水解原理及各种守恒在判断离子浓度大小中的应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 1L溶液里含有NA个SO42- | |
| B. | 1L溶液里K+离子数比SO42-离子数少NA个 | |
| C. | 2L溶液里,阴、阳离子的总数大于4NA个 | |
| D. | 2L溶液里,Al3+离子个数一定小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量C02通入氢氧化钙溶液中:CO2+OH-═HCO3- | |
| B. | Na202加入H2180中:2Na2O2+2H218O═4Na++4OH-+18O2↑ | |
| C. | 硅与氢氟酸的反应:Si+4H++4F-═SiF4↑+2H2↑ | |
| D. | 水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO32-+H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H 2(g)+O 2(g)═2H 2O(g);△H=-483.6KJ•mol -1,则氢气的燃烧热为241.8kJ•mol -1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H 2O(1);△H=-57.4kJ•mol -1则含 20.0gNaOH的稀溶液与稀醋酸完全中和,放出小于28.7kJ的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| D. | 己知2C(s)+2O 2(g)═2CO 2(g);△H=akJ•mol -1、2C(s)+O 2(g)═2CO(g);△H=bkJ•mol -1,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 过氧化氢的电子式
过氧化氢的电子式
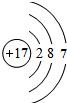 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com