
已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:____________________________________。
由此看来更稳定的碳的同素异形体为:____________。若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为_____________(用含Q的代数式表示)
C(金刚石、s)=C(石墨、s) △H=-1.90kJ/mol;石墨;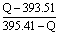
【解析】
试题分析:根据盖斯定律可知,①-②即得到C(金刚石、s)=C(石墨、s),所以该反应的反应热△H=-395.41kJ/mol+393.51kJ/mol=-1.90kJ/mol。根据热化学方程式可知,金刚石的能量高于石墨的,所以石墨比金刚石稳定;设金刚石和石墨的物质的量分别是x和y,则x+y=1mol。根据热化学方程式可知,395.41kJ/mol×x+393.51kJ/mol×y=QkJ,解得x︰y=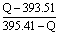 。
。
考点:考查反应热的有关计算以及热化学方程式的书写
点评:根据热化学方程式计算反应热时,一般常依据盖斯定律进行。该题的最后一问,也可以通过十字交叉法进行。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol (理想)气体分子化学键所放出的能量称为键能。下表是一些键能数据(单位为KJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:
_________ <C-Br键能<__________
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QKJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) = O+2(g)+ e— △H1= +1175.7 kJ·mol-1
PtF6(g) + e—= PtF6—(g) △H2=-771.1 kJ·mol-1
O2+PtF6—(s)= O2+(g) + PtF6—(g) △H3= +482.2 kJ·mol-1
则反应O2(g)+ (g)= O2+PtF6— (s)的△H=___________________ kJ·mol-1。
(4)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石,s)+O2(g) =CO2(g) △H=-395.4 kJ•mol-1
C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ•mol-1
则石墨转化为金刚石时的热化学方程式为
由此看来碳的这两种同素异形体中更稳定的为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:______________。
问题2:不同化学反应进行的快慢和程度千差万别。在复杂的反应中,要考虑反应的先后顺序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
(1)第二个离子反应的离子方程式是
(2)最后一个离子反应的离子方程式是
问题3:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平的该反应的化学方程式: 。
问题4:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2010年安丘中学高二暑期练习化学卷(二) 题型:填空题
将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:______________。
问题2:不同化学反应进行的快慢和程度千差万别。在复杂的反应中,要考虑反应的先后顺序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
(1)第二个离子反应的离子方程式是
(2)最后一个离子反应的离子方程式是
问题3:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平的该反应的化学方程式: 。
问题4:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2013届山东省高二上学期模块检测化学试卷 题型:填空题
(12分)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol (理想)气体分子化学键所放出的能量称为键能。下表是一些键能数据(单位为KJ·mol-1)
|
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
|
C-F |
427 |
C-Cl |
330 |
C-I |
218 |
|
H-H |
436 |
S=S |
255 |
H-S |
339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:
_________ <C-Br键能<__________
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QKJ·mol-1;则Q=
(3) 已知下列热化学方程式:
已知下列热化学方程式:
O2 (g) = O+2(g) + e— △H1= +1175.7 kJ·mol-1
 PtF6(g) + e—= PtF6—(g)
△H2=-771.1 kJ·mol-1
PtF6(g) + e—= PtF6—(g)
△H2=-771.1 kJ·mol-1
O2+PtF6—(s) = O2+(g) + PtF6—(g) △H3= +482.2 kJ·mol-1
 则反应O2(g)
+ (g)
= O2+PtF6— (s)的△H=___________________ kJ·mol-1。
则反应O2(g)
+ (g)
= O2+PtF6— (s)的△H=___________________ kJ·mol-1。
(4)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石,s)+O2(g) =CO2(g) △H=-395.4 kJ•mol-1
C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ•mol-1
则石墨转化为金刚石时的热化学方程式为
由此看来碳的这两种同素异形体中更稳定的为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com