
| A.17% | B.5% | C.25% | D.33% |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
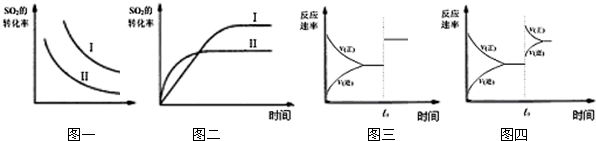
| A.图一研究的是温度、压强对平衡的影响,横坐标表示压强 |
| B.图二研究的是温度对平衡的影响,Ⅱ采用的温度更高 |
| C.图三中t0时使用了催化剂,使平衡向正反应方向进行 |
| D.图四中t0时增大了SO2的浓度,使平衡向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正反应是吸热反应 |
| B.(m+n)<(p+q) |
| C.压强增大,A的转化率减小 |
| D.温度升高,A的转化率减小 |
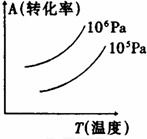
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4molA+2molB |
| B.3molC+1molD+2molA+1molB |
| C.3molC+1molD+1molB |
| D.3molC+1molD |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.K2和K1的单位均为mol/L |
| B.K2<K1 |
| C.c2(CO)=c2(H2O) |
| D.c1(CO)>c2(CO) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com