


 ;818O的质子数位8,质量数位18,中子数为18-8=10,核外电子数是8,9g818O2的物质的量为
;818O的质子数位8,质量数位18,中子数为18-8=10,核外电子数是8,9g818O2的物质的量为| 9g |
| 36g/mol |
 ;8;10;3.01×1023.
;8;10;3.01×1023.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |


| ||
| ||
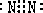
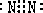


查看答案和解析>>
科目:高中化学 来源: 题型:

请回答下列问题:
(1)写出Z的原子结构示意图_______________。
(2)写出图中D的电子式_______________。
(3)确定图中单质F的依据是_______________。
(4)利用图中反应③在标准状况下生成
(5)写出图中G溶液与H溶液相混合发生反应的离子方程式_______________。
(6)如下图所示装置,两玻璃管中盛有A饱和溶液,两极为多孔石墨电极,给两极分别通入X2、Z2气体,电流表的指针发生偏转;通入X2气体的电极名称是_______________(填写“正极”或“负极”);通入Z2气体的电极反应式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴写出铬的原子结构示意图为 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。
⑵ CCl4分子中C原子采取 杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号)
a.2个σ键 b.2个π键 c.1个σ键、1个π键
⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com