
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2 NA | |
| B. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
分析 A、求出氯气的物质的量,然后根据氯气与碱的反应为歧化反应来分析;
B、将氯化钠溶于1L水后,溶液体积大于1L;
C、根据反应后钠元素为+1价来分析;
D、标况下三氧化硫为固体.
解答 解:A、标况下2.24L氯气的物质的量为0.1mol,而氯气与碱的反应为歧化反应,故0.1mol氯气转移0.1mol电子即0.1NA个,故A错误;
B、将氯化钠溶于1L水后,溶液体积大于1L,故所配置的溶液的浓度将小于1.00mol/L,故B错误;
C、由于反应后钠元素为+1价,故1mol钠失去1mol电子即NA个,故C正确;
D、标况下三氧化硫为固体,故0.1NA个三氧化硫的物质的量为0.1mol,但体积小于2.24L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH3 | B. | NO2 | ||
| C. | HCl | D. | 体积比为4:1的NO2和O2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
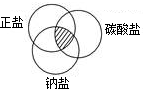 对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.
对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 以Al作阳极,Fe作阴极,可以实现铁上镀铝 | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 | |
| D. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一反应中,氧化剂失电子的总数一定等于还原剂得电子的总数 | |
| B. | 氧化剂在反应中被还原,生成氧化产物 | |
| C. | 氧化还原反应的特征是有化合价的升降 | |
| D. | 任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂必须为不同种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com