
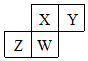 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
分析 W原子的质子数是其最外层电子数的三倍,W位于第三周期,设最外层电子数为x,则2+8+x=3x,解得x=5,可知W为P,结合短周期元素X、Y、Z、W在元素周期表中的相对位置可知,Z为Si,X为N,Y为O,以此来解答.
解答 解:由上述分析可知,X为N,Y为O,Z为Si,W为P,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Z>W>X>Y,故A正确;
B.X的最高价为+5价,位于ⅤA族,Z的最高价为+4价,位于ⅣA族,故B正确;
C.O不存在正价,非金属性X>W,则最高价氧化物对应水化物的酸性:X>W,故C错误;
D.非金属性Y>X>W>Z,最简单气态氢化物的热稳定性为Y>X>W>Z,故D正确;
故选C.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | 用Na2SiO3溶液制备木材防火剂 | D. | 用K2FeO4作为高效水处理剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:NH4+,Ca2+,NO3-,Cl- | |
| B. | c(OH-)=1×10-13mol•L-1的溶液:Na+,K-,ClO-,SO42- | |
| C. | 0.1mol•L-1的FeCl2溶液:K+,Na+,SO42-,Br- | |
| D. | 0.1mol•L-1的酸性KMnO4溶液:Na+,Mg2+,NO3-,SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:818O | |
| B. | HF的电子式:H+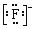 | |
| C. | Cl-离子的结构示意图: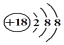 | |
| D. | N2的结构式::N≡N: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
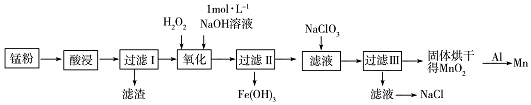
 ,NaClO3中所含的化学键类型有离子键和共价键.
,NaClO3中所含的化学键类型有离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止轮船外壳生锈,在船底装上锌块 | |
| B. | 镀锌铁表面锌有划损时,也能阻止铁被氧化 | |
| C. | 在空气中金属铝表面迅速氧化形成保护层 | |
| D. | 锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com