
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、0.01 mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D、在化学平衡、电离平衡、水解平衡中,平衡常数都随温度的升高而增大 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
| A、2AB(g)?A2(g)+B2(g)△H>0 |
| B、A2(g)+3B2(g)?2AB3(g)△H<0 |
| C、A(s)+B(g)?C(g)+D(g)△H>0 |
| D、2A(g)+B(g)?3C(g)+D(s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4--天然气 |
| B、CO2--水煤气 |
| C、CuSO4?5H2O--明矾 |
| D、NaHCO3--苏打粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无机物 | B、有机物 |
| C、盐类 | D、非金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
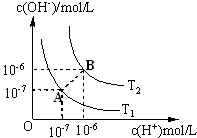 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
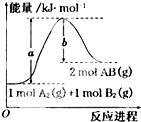
| A、每生成2分子AB吸收bkJ热量 |
| B、加入催化剂,该化学反应的反应热变大 |
| C、断裂1molA-A和1molB-B键,放出akJ能量 |
| D、该反应热△H=+(a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四氯化碳和液溴 |
| B、汽油和花生油 |
| C、花生油和水 |
| D、酒精和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com