
(1)通电所需的时间。
(2)生成NaOH的质量。
科目:高中化学 来源: 题型:
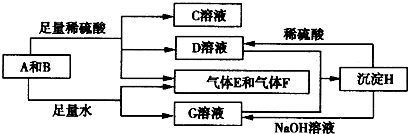
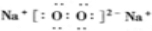
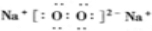
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
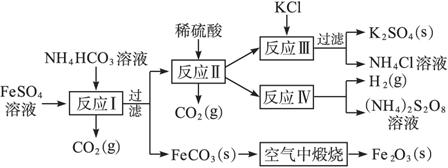
(1)反应Ⅰ前需在FeSO4溶液中加入_______________(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑
C.KI溶液D.H2
(2)反应Ⅰ需控制反应温度低于
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是_______________。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读下表中短周期主族元素的相关信息。
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
请回答:(1)、在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提供能源。写出该原电池正极的电极反应式 。
(2)、用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:
其中,阴极产物是
(3)、常温下,0.1 mol·L-1X溶液的pH 7(填“>”、“=”或“<”),原因是 (用离子方程式说明)。
(4)、已知Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38。
现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
(填字母代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com