
| A. | 16.25 | B. | 17.41 | C. | 15.51 | D. | 17.10 |
分析 无论铁是否过量,氯气能将金属氧化为最高价,则铁在氯气中燃烧的产物是氯化铁,发生反应为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,先判断过量情况,然后根据不足量计算出生成氯化铁的物质的量,最后根据m=nM计算出生成氯化铁的质量.
解答 解:Fe与氯气发生的反应为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
标准状况下3.36L氯气的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,根据反应可知,0.15mol氯气完全反应消耗Fe的质量为:56g/mol×0.15mol×$\frac{2}{3}$=5.6g<6g,说明铁过量,氯气不足,
则二者完全反应生成氯化铁的物质的量为:n(FeCl3)=$\frac{2}{3}$n(Cl2)=0.15mol×$\frac{2}{3}$=0.1mol,理论上最多可以得到氯化铁的质量为:162.5g/mol×0.1mol=16.25g,
故选A.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应原理为解答关键,注意铁与氯气反应生成的是氯化铁,与反应物的量无关,为易错点,试题培养了学生的化学计算能力.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶液中的溶解度:Na2CO3<NaHCO3 | |
| C. | 与稀盐酸反应快慢:Na2CO3<NaHCO3 | |
| D. | 相同物质的量时二者与盐酸反应,消耗盐酸:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
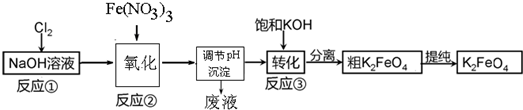

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
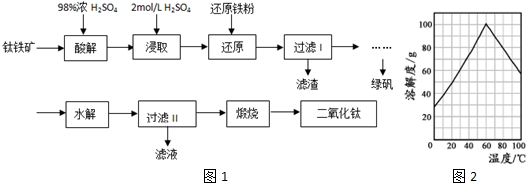
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=1 135.7 kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1 135.7 kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=1 135.7 kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1 135.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 往BaCl2溶液中通入少量CO2有白色沉淀生成 | |
| C. | 医用酒精、冰醋酸、液态HCl都是混合物 | |
| D. | 乙酸乙酯和一氯乙烷在一定条件下均可水解生成乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com