
|
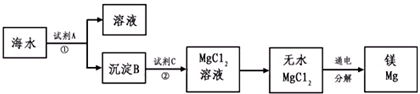
海水中含的氯化镁是镁的重要来源之一.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降,过滤,洗涤沉淀物;③将沉淀物与盐酸反应、结晶、过滤、干燥产物;④将产物熔融后电解.关于提取镁,下列说法中不正确的是 | |
| [ ] | |
A. |
此法的优点之一是原料的来源丰富 |
B. |
进行①②③步骤的目的是从海水中提取MgCl2. |
C. |
第④步电解时会产生氯气 |
D. |
以上提取镁的过程中涉及到的反应有复分解反应、化合反应和置换反应 |
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:必修一导学指导化学苏教版 苏教版 题型:021
|
海水中含的氯化镁是镁的重要来源之一.从海水中提取镁,可按如下步骤:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤,干燥产物;④将产物熔融后电解. 关于提取镁,下列说法不正确的是 | |
A. |
此法的优点之一是原料的来源丰富 |
B. |
进行①②③步骤的目的是从海水中提取MgCl2 |
C. |
第④步电解时只得到目标产物金属镁 |
D. |
以上提取镁的过程中涉及的反应有复分解反应、化合反应 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
海水中含的氯化镁是镁的重要资源之一,从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降,过滤,洗涤沉淀物;③将沉淀物与盐酸反应、结晶、过滤、干燥产物;④将产物熔融后电解.
关于提取镁,下列说法中不正确的是
[ ]
A.此方法的优点之一是原料的来源丰富
B.进行①②③步骤的目的是从海水中提取
C.第④步电解时会产生氯气
D.涉及的反应有化合反应、复分解反应和置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO![]() 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6NO![]() +10Al+18H2O=3N2↑+10Al(OH)3+6OH-
+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下11.2L氮气时,转移的电子为 mol。现在要除去1m3含氮元素0.4mol的废水中的N0![]() (设氮元素都以NO
(设氮元素都以NO![]() 的形式存在,下同),则至少需要消耗金属铝 g。
的形式存在,下同),则至少需要消耗金属铝 g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为 ,若要除去1m3含氮元素0.3mol的废水中的NO![]() ,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com