
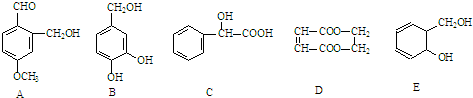
分析 含-OH的物质与Na反应,含酚-OH、-COOH、-COOC-的物质与NaOH反应,含-COOH和酚-OH的物质与碳酸钠反应,含-COOH的物质与碳酸氢钠反应,以此来解答.
解答 解:(1)A B C E中均含-OH,与Na反应生成氢气,故答案为:ABCE;
(2)B中含酚-OH,C中含-COOH,D中含-COOC-,均与NaOH反应,故答案为:BCD;
(3)B中含酚-OH,C中含-COOH,均与碳酸钠反应,故答案为:BC;
(4)C中含-COOH,与碳酸氢钠反应,故答案为:C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质及分析与应用能力的考查,题目难度不大.


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


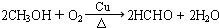 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精的燃烧热为Q3 kJ | |
| B. | 若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 | |
| D. | 从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
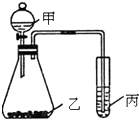 按要求完成下列各题:
按要求完成下列各题: .H2O的电子式为
.H2O的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com