
如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )

A.该反应的热化学方程式为:2NH3N2+3H2 ΔH=-92 kJ·mol-1
B.正反应的活化能小于逆反应的活化能
C.a曲线是加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速率,降低逆反应速率
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是 ( )

A.双酚A的相对分子质量为228
B.双酚A的核磁共振氢谱显示氢原子数之比为1:2:2:3
C.反应①中,1mol双酚A最多消耗2mol Br2
D.反应②的产物只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
湖北荆门某化工厂违规快递有毒化学品,因泄漏导致9人中毒,1人死亡。涉事有毒化学品名为氟乙酸甲酯(C3H5O2F),其具有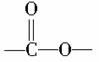 结构的同分异构体还有(不考虑—O—F结构及立体异构)( )
结构的同分异构体还有(不考虑—O—F结构及立体异构)( )
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源: 题型:
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯,它是一种无色透明液体,不溶于水,稍有水果气味。用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为: +CH3CH2OH
+CH3CH2OH
 +H2O
+H2O
已知:
| 名称 | 相对分子质量 | 颜色、状态 | 沸点(℃) | 密度(g·cm-3) |
| 苯甲酸* | 122 | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100 ℃会迅速升华。
实验步骤如下:

①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25 mL 95%的乙醇(过量)、20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在65~70 ℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层。加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213 ℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)步骤①中加入沸石的作用是________________;如果加热一段时间后发现忘记加沸石,应该采用的正确操作是______________。
(2)步骤①中使用分水器不断分离除去水的目的是__________。
(3)步骤②中应控制馏分的温度在________。
A.65~70 ℃ B.78~80 ℃
C.85~90 ℃ D.215~220 ℃
(4)步骤③加入Na2CO3的作用是________________;采取分批加入Na2CO3而不是一次性加入的原因是________________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________________。
(5)关于步骤③中的分液操作叙述正确的是________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ/mol)如图所示。请回答下列问题:

(1)观察图像可知上述反应过程中,断裂反应物中的化学键吸收的总能量________________(填“大于”、“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:_________。甲醇分子中的化学键类型是________________(填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是________________,发生的是________________(填“氧化”或“还原”)反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:_____。
(5)下列事实能表明该反应已达平衡状态的是_______(填代号)。
A.CO2(g)的浓度不再发生变化
B.单位时间内消耗1 mol CO2的同时生成3 mol H2
C.在—个绝热的容器中,混合物的温度不再发生变化
D.在一个容积固定的容器内,压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2NH3(g)N2(g)+3H2(g) ΔH=+92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质 物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量a kJ |
| ② | 0 | 1 | 3 | 放出热量b kJ |
| ③ | 4 | 0 | 0 | 吸收热量c kJ |
下列叙述正确的是( )
A.热量关系:a=b
B.①②③反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的装置中发生反应2A2(g)+B2(g)2C(g) ΔH=-a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2 mol A2和1 mol B2,两容器分别在500 ℃时达平衡,A中C的浓度为w1 mol/L,放出热量b kJ,B中C的浓度为w2 mol/L,放出热量c kJ。请回答下列问题:

(1)此反应的平衡常数表达式为________________;若将温度升高到700 ℃,反应的平衡常数将________(填“增大”、“减小”或“不变”)。
(2)比较大小:w1________w2(填“>”、“=”或“<”),a、b、c由大到小的关系为________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将________
(填“增大”、“减小”或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,在500 ℃时达平衡后C的浓度为w3 mol/L,则w1、w3的关系为_________。
(5)能说明A中已达到平衡状态的是________________(填序号,有一个或多个选项符合题意)。
a.v(C)=2v(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出C气体
b.适当升高温度
c.增大B2的浓度
d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2
B.实验室检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈
红色
C.灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
D.浓硝酸有强氧化性,常温下能与Fe发生剧烈反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com