
| A. | 它位于周期表的第五周期,第I A族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
分析 A.Rb和K位于同一主族,且在K元素下一周期;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.金属晶体中,金属键越强其熔沸点越高,金属键与原子半径成反比;
D.活泼金属和酸根离子之间易形成离子键.
解答 解:A.Rb和K位于同一主族,且在K元素下一周期,所以Rb位于第五周期第IA族,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Rb>K,KOH是强碱,所以Rb也是强碱,故B错误;
C.金属晶体中,金属键越强其熔沸点越高,金属键与原子半径成反比,金属键Na>K>Rb,所以单质的熔沸点中钠最高,故C错误;
D.Rb是活泼金属,易和硝酸根离子之间形成离子键,所以硝酸铷是离子化合物,故D正确;
故选AD.
点评 本题以铷为载体考查碱金属元素,侧重考查同一主族元素性质递变规律及知识迁移能力,以钠、钾为例采用知识迁移的方法解答即可,题目难度不大.


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石,晶体硅,碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>CsCl>NaCl | D. | Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CHCl3的碳原子总数为0.1 NA | |
| B. | 1 mol甲醇中含有C-H键的数目为4NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 实验室制乙炔 | 用电石和饱和食盐水反应,将产生的气体再通入到硫酸铜溶液中除杂 |
| B | 检验溴乙烷在氢氧化钠溶液中是否发生水解 | 将溴乙烷和氢氧化钠溶液共热.冷却后,取上层清液,用稀硝酸酸化,再加硝酸银溶液,观察是否产生淡黄色沉淀 |
| C | 除去乙烷中的乙烯气体 | 将混合气体通入到装有高锰酸钾溶液的洗气瓶中 |
| D | 验证氢氧化铁的溶解度小于氢氧化镁 | 将氯化铁溶液加入到氢氧化镁悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
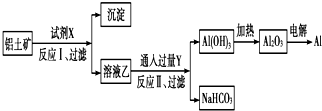
| A. | 试剂X为NaOH溶液 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| C. | 结合质子(H+)的能力由强到弱的顺序是OH->[Al(OH)4]->CO32- | |
| D. | 工业上还可采用热还原法冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片、石墨棒,酒精 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内壁沾有水滴没有烘干就进行配制 | |
| B. | 转移液体时有少量洒落 | |
| C. | 量取浓硫酸时仰视刻度线 | |
| D. | 定容摇匀后液面下降再加水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com