
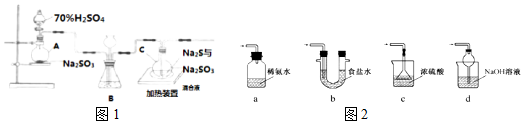
分析 (1)仪器a为圆底烧瓶,生成气体二氧化硫的反应为浓硫酸和亚硫酸钠反应;
(2)平衡装置内外压强,观察SO2的生成速率,则二氧化硫通过溶液不能与SO2反应,有气泡逸出;
(3)通过分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率;根据C中发生的反应可知,烧瓶C中反应达到终点发生的反应为硫与亚硫酸钠反应生成硫代硫酸钠;
(4)酸性溶液中硫代硫酸根离子会反应生成单质硫,为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上先通一会二氧化硫气体吧空气排净,反应结束后,过滤C中的混合物得到滤液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤、干燥;
(5)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
解答 解:(1)仪器a为圆底烧瓶,生成气体二氧化硫的反应为浓硫酸和亚硫酸钠反应
故答案为:圆底烧瓶;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,用饱和NaHSO3溶液,与二氧化硫不反应,装置作用起到缓冲装置(或者平衡装置内外压强等)、观察SO2生成速率的作用,
故答案为:缓冲装置(或者平衡装置内外压强等)、观察SO2生成速率;
(3)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),故答案为:控制滴加硫酸的速度;溶液变澄清(或浑浊消失);
(4)酸性溶液中硫代硫酸根离子会反应生成单质硫,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O,为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上先通一会二氧化硫气体吧空气排净,再打开加热装置,避免了亚硫酸钠被氧化为硫酸钠,反应结束后,过滤C中的混合物得到滤液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到产品,
故答案为:S2O32-+2H+═S↓+SO2↑+H2O; 先通一段时间SO2后再打开加热装置;蒸发;
(5)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d.
点评 本题考查物质的制备实验、实验方案设计,为高频考点,侧重于学生的分析能力、实验能力的考查,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁粉与50mL 4mol/L盐酸反应转移电子的数目为0.15NA | |
| B. | 常温下1 L pH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA | |
| C. | 标准状况下,8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA | |
| D. | 1mol苯中所含碳碳双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏可得到煤油、石蜡和沥青 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 氧化铝可用来制造耐高温的容器 | |
| D. | 装有硅胶的透气袋可防止富含油脂的月饼被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
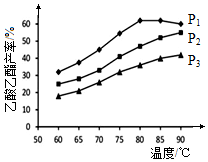 醋酸由于成本较低,在生产中被广泛应用.
醋酸由于成本较低,在生产中被广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
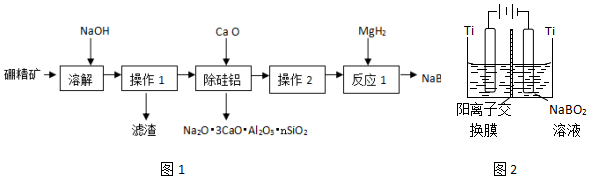
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
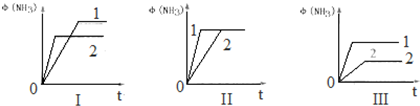
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com