
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A.42g NaHCO3晶体中含有CO32-的数目为0.5NA
B.1 mol OH-和17 g NH3所含的电子数相等
C.1 mol Cl2参加反应转移电子数一定为2NA
D.2.0g H216O与D216O的混合物中所含中子数为NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于化工生产的叙述中,符合目前工业生产实际的是( )
A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品
B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率
D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
A.在100℃、101kpa条件下,液态水的气化热为40.69kJ/mol,则H2O(g) ![]() H2O(l)的△H=40.69kJ/mol
H2O(l)的△H=40.69kJ/mol
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体的溶液中,都有c(Mg2+)=c(CO32-)=6.82×10-6
C.已知: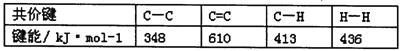 ,则可以计算出反应
,则可以计算出反应 的△H为-384kJ/mol
的△H为-384kJ/mol
D.常温下,在0.10mol/L的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
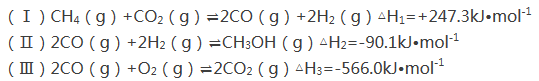
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向容积为4 L的容器通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为![]() ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧显示屏玻璃中含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[化学式为xFe2(SO4)3·y(NH4)2SO4·zH2O],流程设计如下:
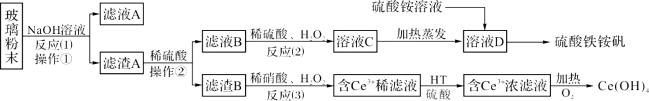
已知:Ⅰ、酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ、CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)操作①的名称是_____________;该操作所用的玻璃仪器有:烧杯、_________、_________。
(2)反应(2)中过氧化氢的作用是:_________________________。
(3)反应(3)的离子方程式是:_____________________。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+(水层)+6HT(有机层)![]() 2CeT3(有机层)+6H+(水层)
2CeT3(有机层)+6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是_________________。
(5)硫酸铁铵矾广泛用于水的净化处理,其净水原理用离子方程式表示为:_________________。
(6)相同物质的量浓度的以下四种溶液中,铵根离子浓度由大到小的顺序是:_________________。
a.xFe2(SO4)3·y(NH4)2SO4·zH2O
b.(NH4)2SO4
c.(NH4)2CO3
d.NH3·H2O
(7)为测定某硫酸铁铵矾样品的组成,现称取14.00 g该样品,将其溶于水配制成100 mL溶液;再将溶液分成两等份,向其中一份加入足量氢氧化钠溶液,过滤、洗涤沉淀、再烘干灼烧至恒重,得到1.60 g固体;向另一份溶液中加入0.5 mol/L硝酸钡溶液100 mL,恰好完全反应。则该硫酸铁铵矾的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述不正确的是( )
A.甲烷和乙烯都可以与氯气反应,反应类型不同
B.蔗糖、油脂、蛋白质都可以水解
C.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
D.乙醇和乙酸都存在碳氧双键,二者可以发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4 L水中含有的水分子数为NA
B.常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C.1mol/L的Ba(NO3)2溶液中含NO3-离子数为2NA
D.分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于DNA与RNA的叙述,正确的是( )
A. 在细胞内存在的主要部位相同 B. 构成的五碳糖不同
C. 核苷酸之间的连接方式不同 D. 构成的碱基相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为合成氨的原料。完成下列填空:
![]()
(1)半水煤气含有少量硫化氢。将半水煤气样品通入 溶液中(填写试剂名称),出现 ,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式 ;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中:V(H2): V(N2)=__________。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠洛液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol.L-1的标准盐酸溶液VlmL,此时再向溶液中滴入1-2滴__________做指示剂,达到滴定终点时又用去V2mL标准盐酸溶液。
第二次滴定达到终点时的现象是______________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则____________(填化学式)浓度偏大。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com