
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
分析 由合金的形成可知,两种金属若能够形成合金,则熔点较高的金属的熔点不能大于熔点较低的金属的沸点.
解答 解:合金是不同种金属在熔化状态下形成的一种熔合物,即两种金属都成为液态时进行混合;
A.由于金属Na的沸点较低,Cu的熔点高于Na的沸点,在铁熔化时温度达1535℃,而此时金属Na已变成气态,无法完成液态时混合,故Cu和Na不能形成合金,故A正确;
B.铁的熔点低于铝的沸点,两种金属能够形成合金,故B错误;
C.铁的熔点低于铜的沸点,两种金属能够形成合金,故C错误;
D.铝的熔点低于钠的沸点,两种金属能够形成合金,故D错误;
故选A.
点评 本题考查了合金的形成条件,题目难度不大,注意制造合金时,两种金属必须都是液态才能制成合金,一种液态、一种气态不会转化成合金.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
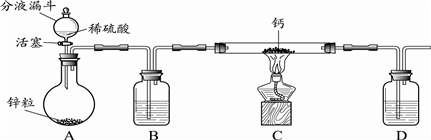
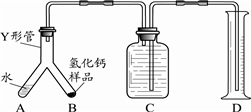
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
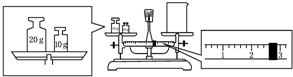 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外电子层上有7个电子 | D. | 砹能从NaCl溶液中置换出氯单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
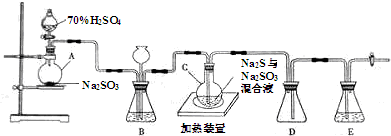
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶于100mL水中 | 配制0.1mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1-2mLFeCl3饱和溶液,搅拌并继续煮沸到变成红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性 |
| D | 用MgCl2、AlCl3溶液做导电性试验 | 证明两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向50 mL 1 mol•L-1明矾溶液中滴入少量0.1 mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4C1- | |
| C. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com