
【题目】利用反应Zn+Cu2+= Zn2++ Cu设计成原电池。则该电池的负极、正极和电解质溶液选择合理的是
A. Zn、Cu、ZnSO4B. Cu、Zn、 ZnCl2
C. Cu、Zn、CuCl2D. Zn、Cu、CuSO4
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列对实验装置图、实验操作及结论描述正确的是( )
A.
打开弹簧夹,由漏斗中加水至产生液面差,液面高度差不变时,说明装置气密性良好
B.
打开弹簧夹一段时间后,红墨水倒吸入导气管中,说明铁钉发生了析氢腐蚀
C.
滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明产生了还原性气体
D.
加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某强氧化剂[RO(OH)2]2+离子2.4×10-3mol被亚硫酸钠还原到较低价态,需12mL0.2mol/L的亚硫酸钠溶液,则反应后R的化合价为( )
A.0B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓通入到含有等物质的量的KOH,Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( ) 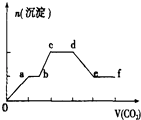
A.d~e段沉淀的减少是由碳酸钡固体的消失所致
B.b~c段反应的离子方程式是:2A1O2﹣+3H2O+CO2=2A1(OH)3↓+CO32﹣
C.0~a段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O
D.a~b段与c~d段所发生的反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的-CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O=2NaHCO3 , CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是。
(2)大理石与稀盐酸反应的离子方程式为。
(3)装置二中饱和碳酸氢钠溶液的作用是。
(4)【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
雯雯在最初的实验中没有看到沉淀现象的原因是。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)2NO(g) K1=1×10﹣30
②2H2(g)+O2(g)2H2O(g) K2=2×1081
③2CO2(g)2CO(g)+O2(g) K3=4×10﹣92
下列说法正确的是( )
A.NO分解反应NO(g)? ![]() N2(g)+
N2(g)+ ![]() O2(g)的平衡常数为1×10﹣30
O2(g)的平衡常数为1×10﹣30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO,H2O,CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com